Лечение на системен лупус еритематозус. Системен лупус еритематозус и други системни заболявания на съединителната тъкан, как да се диференцира
Хронична, прогресираща полисиндромна болест, която се среща 10 пъти по-често при жените, отколкото при мъжете, и се характеризира с генетично обусловено развитие на автоимунитет - наличието на широк спектър от автоантитела, включително нативната ДНК. SLE се засяга главно от жени на възраст 15-30 години. SLE принадлежи към групата на дифузни заболявания на съединителната тъкан.
Етиология и патогенезаSLE не се разбира добре. Предполага се комбинираният ефект на факторите на околната среда, генетични, хормонални и социални. Възможно е спусъкът на SLE да се активира вируси (предимно ретровируси и близки до тях) в организма, предразположен към болестта.
Значението на генетичните фактори се потвърждава от честата фамилна агрегация на SLE или системни заболявания като ревматоиден артрит, висока чувствителност на монозиготни близнаци, асоцииране с наличието на HLA-DR2 или HLA-DR3, дефицит на компонента на комплемента С4. При пациенти със SLE, като правило, има нарушен естрогенен метаболизъм и склонност към хиперпролактинемия, които наред с преобладаващата честота на жените в детеродна възраст показват влиянието на хормоналните фактори върху развитието на заболяването. В същото време не може да се изключи влиянието на факторите на околната среда: фотосенсибилизация, стрес, недохранване, тютюнопушене. Сред специфичните механизми на развитието на болестта е доказан ефектът на имунните разстройства в Т-клетъчния репертоар и в производството на цитокини (лимфокини и монокини), които участват в активирането и диференцирането на В-лимфоцитите в клетки, произвеждащи антитела. Последното води до свръхпродукция на различни антитела (включително автоантитела). Най-проучваното патогенетично значение на антитела към нативната ДНК (nDNA), циркулиращи комплекси от nDNA - антитела към nDNA - се допълват, които, отложени върху мазевите мембрани на бъбреците, кожата, различни органи, причиняват увреждане на тъканите с възпалителна реакция. В процеса на възпаление и разрушаване на съединителната тъкан се отделят нови антигени, в отговор на които се образуват антитела, образуват се имунни комплекси и по този начин се създава порочен кръг. Хипокомплементемията свидетелства в полза на патогенетичното значение на циркулиращите имунни комплекси, т.е. намаляване на съдържанието както на цялото комплемент (СН50%), така и на неговите компоненти - С3, С4, С9, С10.
Клиничната картина.SLE се наблюдава главно при жени на възраст 20-30 години, обаче, появата на болестта все по-често се открива при подрастващите. Характерно е постепенното развитие на ставен синдром, наподобяващ ревматоиден артрит, неразположение и слабост (астеновегетативен синдром), висока температура, поява на кожни обриви, трофични разстройства, бърза загуба на тегло. По-рядко в началото на заболяването има висока температура, остра болка в ставите и подуването им, силен кожен синдром. В бъдеще SLE придобива рецидивиращ курс, като постепенно в процеса участват различни органи и системи.
Клинична картинаХарактеризира се с полиморфизъм на симптомите и прогресията; често има фатален изход поради недостатъчна функция на определен орган или присъединяване на вторична инфекция.
Увреждане на ставите -Най-честият симптом, наблюдаван при 80-90% от пациентите, обикновено е под формата на миграционна артралгия или артрит, по-рядко под формата на персистиращ болков синдром с болкови контрактури. Засягат се предимно малките стави на ръцете, китката, глезенните стави, но са засегнати и големите стави. Подуването на ставите по-често се причинява от периартикуларен оток, по-рядко - синовит. Някои пациенти могат да развият деформация на малки стави (вретеновидни пръсти), придружена от мускулна атрофия, особено изразена на задната повърхност на ръцете. Ставният синдром обикновено е придружен от постоянна миалгия, миозит. Рентгеново изследване разкрива епифизна остеопороза главно в ставите на ръцете и китката; само при хроничен полиартрит и деформации е стесняване на ставните пространства, главно в междуфаланговите стави на ръката, по-рядко в карпално-метакарпалните и китката стави, изтъняване на субхондрални плочи, малки пластири на ставните костни краища с сублуксации. Биопсията на синовиалната мембрана разкрива остър или подостър синовит с "лоша" клетъчна реакция, значима ядрена патология и откриване на хематоксилинови тела.
Кожен покривТе са засегнати почти толкова често, колкото ставите. Най-типичните еритематозни обриви по лицето в областта на зигоматичните арки и задната част на носа ("пеперуда"). Повтарящите се очертания на "пеперудата", възпалителните обриви по носа и бузите имат голяма диагностична стойност и се наблюдават в различни варианти, различаващи се по тежестта и продължителността на възпалителните явления: 1) съдова (васкулитна) "пеперуда" - нестабилна, пулсираща, дифузно зачервяване с цианотичен оттенък в средната зона лица, утежнени от външни фактори (инсолация, вятър, студ и др.) или вълнение; 2) тип "пеперуда" от центробежен еритем.
Поражението на серозните мембрани -Признак на класическата диагностична триада (дерматит, артрит, полисерозит) - се наблюдава при почти 90 % Пациентите. Особено често има лезии на плеврата, перикарда, по-рядко - перитонеума, обикновено под формата на сух или излив серозит. В същото време изливанията са малки и по цитологичен състав наподобяват тези в ревматичния процес. Клиничните прояви на серозит са чести (болка, перикардно триене, плевра и др.), Но поради рядкостта на масивните ексудати и тенденцията за бързо изчезване, те лесно се наблюдават от клиницистите и могат да бъдат диагностицирани ретроспективно чрез плевроперикардиални комисии или удебеляване на реберната, интерлобарната, медиастиналната плевра. Рентгеново изследване. Има изразена склонност на възпалителния процес в серозните мембрани към пластични процеси с облитерация на плевралните кухини, перикард. Ограничен фибринозен перитонит под формата на периспланит, перихепатит, обикновено открит по време на аутопсия, е чест.
Увреждане на сърдечно-съдовата системаТой е много характерен за SLE и се наблюдава в различни етапи на заболяването. Обикновено две или три мембрани на сърцето се засягат последователно. Най-често се отбелязва перикардит, който има явна тенденция към рецидив и заличаване на перикарда. Много по-често, отколкото се смяташе, атипичният брадавичен ендокардит (болест на Либман-Сакс) се наблюдава с увреждане на митралната, трикуспидната и аортната клапа. В миокарда се отбелязват фокални или (по-рядко) дифузни възпалителни или дистрофични процеси. Признаци за съдово увреждане при SLE са включени в характеристиките на лезиите на отделните органи. Може би развитието на синдрома на Рейно (много преди да се открие пълната картина на заболяването), поражението както на малки, така и на големи артериални и венозни стволове (ендартерит, флебит).
Белодробни лезииТе могат да бъдат свързани с основното заболяване или с вторична банална, обикновено пневмококова инфекция. Лупус еритематозус в белите дробове (пневмонит) или се развива много бързо, или продължава с месеци. В острия си ход пациентите се безпокоят от задух, болезнена кашлица, често суха или с трудно отделяне на храчки, оцветени с кръв; изразена цианоза на лицето и крайниците. При перкусия на белите дробове обикновено не е възможно да се открият промени. По време на аускултация от двете страни в средната и долната част се чува голям брой необичайно силни дребни мехурчета или крепитация. Радиологично разкрити, като правило, малки промени под формата на укрепване и деформация на белодробния модел, главно поради наличието на съдов компонент, главно в средните долни части на белите дробове; на моменти могат да се открият огнищни сенки. Хроничните интерстициални промени, възпалението на периваскуларната, перибронхиалната и интерлобуларната съединителна тъкан с възможно включване на алвеоларната септа в процеса се характеризират с бавно прогресиращ задух с минимални физически данни. Рентгенологично при тези условия се открива мрежеста структура с подобрен белодробен модел, често висока стояща диафрагма и дискообразна базална ателектаза.
Поражението на стомашно-чревния тракт.В острия период на SLE всички пациенти съобщават за анорексия и диспептични симптоми, неясна коремна болка, диария, които вероятно са причинени не само от промени в стомашно-чревния тракт, но и от сложни неврорефлексни модели.
Особено внимание е синдромът на коремна болка, който може да се дължи на развитието на инфаркт на далака поради васкулит на слезката, вазомоторни мезентериални нарушения, хеморагичен оток на мезентерията и чревната стена с особена повтаряща се запушване на тънките черва при някои пациенти със сегментарен илеит. В редки случаи е възможен некротичен язвен (в основата си и съдов) процес, който дава картина на афтозен стоматит, езофагит и гастроентероколит (понякога водещ до язва перфорация и бактериален перитонит) или панкреатит. Често, особено в терминалния стадий, се наблюдава абдоминален синдром с дразнене на перитонеума (перитонизъм), дължащ се на апоплексия на яйчника.
Увреждане на бъбреците(лупус гломерулонефрит, лупус нефрит) - класически имунокомплексен нефрит, наблюдаван в половината от случаите, обикновено по време на генерализацията на процеса, на фона на изразена автоимунизация; само от време на време заболяването започва с бъбречна патология като нефропатия на бременни жени или остър нефротичен синдром. Има различни варианти за увреждане на бъбреците - изолиран синдром на урината, нефрит и нефротичен; в последните години често се наблюдава синдром на пиелонефрит, особено при пациенти, лекувани с кортикостероиди и цитотоксични лекарства (азатиоприн, циклофосфамид). Като цяло клиничната картина на бъбречната патология съответства на добре познатата. Уринният синдром се проявява с малка протеинурия (до 1 g / l), наличие на постна уринарна утайка. При нефритни и нефротични синдроми се наблюдават смесени симптоми: гломерулонефрит или нефротичен синдром. С радиоизотопна ренография и други методи на функционална диагностика, както и с хистоморфологично (имуноморфологично) изследване на биопсия на бъбреците, лупусният нефрит се открива много по-често, отколкото с чисто клинични методи на изследване. При бъбречна патология при пациенти с рецидивиращ артикуларен синдром, висока температура и трайно повишено СУЕ е необходимо да се изключи лупусната природа на нефрита. Трябва да се помни, че почти всеки пети пациент с нефротичен синдром има SLE.Бипс на бъбреците е от най-голямо значение за разпознаването на лупусния характер на гломерулонефрит. При пациенти се открива характерна комбинация от морфологични признаци на увреждане на гломерулната, интерстициалната тъкан и тръбния апарат. Наличието на хематоксилинови тела и феноменът "телена верига" в препаратите е патогномонично. Имуноморфологично изследване разкрива фиксирането на имуноглобулините и комплемента в мембраната на гломерулната база.
Поражението на невропсихичната сфераИзразява се в различна степен при много пациенти във всички фази на заболяването. Още в самото начало често е възможно да се отбележи астеновегетативният синдром: слабост, умора, адинамия, раздразнителност, потиснато настроение, главоболие или усещане за тежест в главата, нарушение на съня, прекомерно изпотяване и др. В разгара на заболяването полиневритът може да се наблюдава заедно с други прояви с болезненост на нервните стволове, намалени сухожилни рефлекси, чувствителност, парестезии. Напречно миелит с нарушения в таза се наблюдава рядко, в тежки случаи - менингоенцефалополирадикулоневрит.
Обикновено наблюдавани преходни промени в емоционалната сфера на психиката, нестабилно потиснато настроение или еуфория, безсъние, намалена памет и интелигентност. Възможни са налудни състояния, халюцинации, слухови или зрителни, епилептиформни припадъци, нарушена преценка, критика, преоценка на способностите на човек и др.
Когато се оценяват причините за тези разстройства, особено в емоционалната сфера, трябва да се има предвид, че те могат да се развият и във връзка с използването на кортикостероидна терапия (така наречените стероидни психози).
Поражението на ретикулохистиоцитната системаХарактеризира се с развитието на полиадения (увеличение на всички групи лимфни възли) - много чест и, както изглежда, ранен признак за генерализиране на лупусния процес, както и увеличаване на черния дроб и далака.
Увреждане на черния дробКогато SLE е изключително разнообразен. Понякога иктеричен лупус еритематозус хепатит клинично прилича на остър вирусен хепатит. При някои пациенти увеличението на черния дроб може да се дължи на сърдечна недостатъчност при тежък дифузен миокардит или белодробно сърдечно заболяване. По-често обаче се наблюдава мастна дегенерация на черния дроб, при която има изчерпване, мръсно сив тон на кожата, червен (арибофлавинозен), сякаш лакиран език, нестабилност на чревната дейност и значителна промяна в чернодробните проби, по-специално едновременно увеличаване на α2 и γ- глобулин.
За.Като се има предвид тежестта на началото на заболяването и степента на полисиндромия на началния период, скоростта на прогресия, отговорът на лечението с глюкокортикостероиди и общата продължителност на заболяването, въз основа на тежестта на началния период на заболяването, се разграничават 3 вида протичане на SLE: остър, подостър и хроничен.
При острото протичане заболяването обикновено се развива толкова внезапно, че пациентите могат да посочат деня, в който е започнал, треска, остър полиартрит, серозит, наличие на "пеперуда". Общото състояние на пациента е силно нарушено. Още в следващите 3-6 месеца може да се отбележи изразена полисиндромия с участието на бъбреците (обикновено под формата на дифузен гломерулонефрит) и централната нервна система (като менингоенцефаломиелополирадикулоневрит). Продължителността на заболяването в острия курс е от 1 до 2 години, но при постоянно поддържащо лечение с кортикостероиди периодът може да бъде удължен до 5 години или повече, а някои пациенти развиват постоянна клинична ремисия, което позволява да се отмени лечението.
С подостър курс заболяването започва постепенно, с общи симптоми, артралгия, повтарящ се артрит, неспецифични кожни лезии. Вълнуващата клинична картина е особено отчетлива и с всяко обостряне в патологичния процес участват нови органи и системи; в крайна сметка се развива полисиндромизъм, подобен на този, наблюдаван при острия ход на заболяването, със значителна честота на дифузен гломерулонефрит и енцефалит.
В хроничния ход заболяването за дълго време се проявява като отделни рецидиви на определени синдроми: повтарящ се полиартрит и (или) полисерозит, синдром на лупус еритематозус, синдром на Рейно, болест на Верлхоф или епилептиформен синдром. При дълъг курс на заболяване на 5-10-та година могат да се присъединят и други прояви на органи (пневмонит, нефрит и др.). Но дори и в този курс е характерен полисиндромизмът.
Според характера на клиничните, имунологичните и морфологичните характеристики се разграничават 3 степени на активност (Таблица 2).
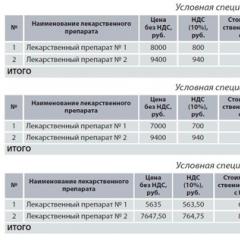
Таблица 2. Клинични и лабораторни характеристики на степента на активност на патологичния процес при SLE
|
Степен на активност |
|||
|
Телесна температура |
38 ° C и повече |
По-малко от 38 ° С |
нормален |
|
Отслабване |
изразена |
умерен |
|
|
Трофично разстройство |
|||
|
Кожна лезия |
Еритема на лицето ("пеперуда") И лупус еритема |
Ексудативна еритема |
Дискоидни огнища |
|
полиартрит |
Остър, подостър |
подостър |
Деформираща артралгия |
|
перикардит |
ексудативна |
лепило |
|
|
миокардит |
Многофокусна, дифузна |
фокален |
Кардиосклероза миокардна дистрофия |
|
ендокардит |
Поражението на много клапи |
Победете един (обикновено Митрал) Клапан |
|
|
ексудативна |
лепило |
||
|
пневмония |
Остър (васкулит) |
Хроничен (интерстициален) |
белодробна фиброза |
|
Нефротичен синдром |
Нефрит или Уринарен синдром |
хроничен гломерулонефрит |
|
|
Нервна система |
Entsefaloradikulonevrit |
Entsefalonevrit |
полиневрит |
|
Хемоглобин (g / l) |
120 и повече |
||
|
ESR (mm / h) |
45 и повече |
||
|
Фибриноген (g / l) |
|||
|
албумин% |
|||
|
Глобулин,% |
|||
|
5: 1000 левкоцити и повече |
1-2: 1000 бели кръвни клетки |
Единична или Отсъстват |
|
|
антинуклеарни Фактор (кредити) |
1: 128 и по-висока |
||
|
Лек тип |
Хомогенни и маргинални |
хомогенен |
|
|
Антитела срещу nDNA (заглавия) |
Диагнозата.При диагностициране на SLE трябва да се вземат предвид клиничната картина, лабораторни данни, имуноморфологични изследвания на биопсичен материал на бъбреците и кожата. В клиничната практика диагностичните критерии, разработени от Американската ревматологична асоциация (ревизия от 1982 г.), могат да бъдат полезни: 1) наличието на еритема на лицето ("пеперуда"): 2) дискоиден лупус; 3) фоточувствителност; 4) перорални язви 5) артрит; 6) серозит; 7) увреждане на бъбреците (протеинурия -0,5 г на ден, наличието на цилиндри в урината); 8) неврологични разстройства (конвулсии или психози); 9) промени в кръвта: а) хемолитична анемия, 6) брой на левкоцитите - 4,0 · 109 / l с две или повече изследвания, в) лимфопения 1,500 · 109 / l с две или повече изследвания, г) тромбоцитопения 100,0 · 109 / л; 10) имунологични нарушения (LE клетки, антитела към ДНК, антитела към Sm антиген, фалшиво-положителна реакция на Васерман); Ii) антинуклеарни антитела. Ако има някакви 4 критерия, диагнозата на SLE е надеждна. Диагнозата обаче представлява значителни затруднения с особени модели на протичане (комбинирани или гранични с други заболявания на съединителната тъкан) в ранните етапи на заболяването.
Лабораторните данни имат диагностична стойност, особено определянето на голям брой LE клетки и антиядрени антитела, патогномонични за SLE във висок титър.
LE клетките са зрели неутрофили, в цитоплазмата на които са открити кръгли или овални големи включвания под формата на хомогенни аморфни бучки, състоящи се от деполимеризирана ДНК и оцветени в лилаво. LE клетките обикновено се откриват при 70% от пациентите със SLE и това обстоятелство обяснява голямото диагностично значение на това явление. В същото време единични LE клетки могат да се наблюдават и при други заболявания.
Голямо значение се отдава на откриването на антинуклеарни реакции, особено във високи, "диагностични" кредити. Сред последните - антитела към естествена ДНК, дезоксирибонуклеопротеин (комплекс от ДНК-хистон), към цели ядра, определени чрез имунофлуоресценция, Sm-антиген; лупус антикоагулант и антитела срещу кардиолипин (антифосфолипиден синдром).
При SLE съдържанието на общия протеин в кръвната плазма (хиперпротеинемия) и неговите фракции се променят сравнително рано. Особено значително увеличава съдържанието на глобулини, по-специално γ-глобулини. В ф-глобулиновата фракция са лупусният фактор, отговорен за образуването на LE клетки, и други антиядрени фактори.
При хроничен полиартрит могат да бъдат открити тежки увреждания на черния дроб, положителни реакции към ревматоидния фактор (реакция на Валер-Роуз) или латексна аглутинация. Изследването на кръвния комплемент също е информативно: понижаването на неговото ниво обикновено корелира с активността на лупус нефрит. При почти всички пациенти ESR е значително повишен - до 60-70 mm / h.
Повече от 50% от пациентите имат левкопения, която в някои случаи достига високи степени (до 1,2 · 109 / l) с изместване на кръвната формула към промиелоцити, миелоцити и млади хора в комбинация с лимфопения (5-10% лимфоцити). Доста често се открива умерена хипохромна анемия, поради или хипоплазия на еритроцитния зародиш, или стомашно, бъбречно кървене, както и бъбречна недостатъчност. В редки случаи се развива хемолитична анемия с жълтеница, ретикулоцитоза, положителна реакция на Кумбс. Възможни са лека тромбоцитопения и синдром на Верлхоф. През последните години антифосфолипидният синдром често се описва в хроничния ход на SLE.
лечениеТой дава най-добър ефект в началните етапи на заболяването. В периоди на обостряне на SLE се провежда стационарно лечение; пациентите трябва да осигуряват добро хранене с достатъчно витамини (особено групи В и С).
При първоначалните субакутни и хронични, главно ставни, варианти на хода на SLE се използват дългосрочни нестероидни противовъзпалителни средства, докато възпалителните явления в ставите отшумят и телесната температура не се нормализира.
При хроничен ход на SLE с преобладаваща кожна лезия се препоръчва продължителна употреба на хлорохин или делагил (хингамин) при 0,25-0,5 g на ден в продължение на 10-14 дни, а след това при 0,25 g 1 път на ден. През последните години при лечението на дифузен лупус нефрит успешно се използва плакенил, 0,2 g 4-5 пъти на ден, в някои случаи увеличаването на дозата до 0,4 g 3-4 пъти на ден (страничните ефекти са редки).
Основното лечение на SLE са глюкокортикоидните лекарства, предписани за обостряне на заболяването, генерализиране на процеса, разпространение на последното към серозните мембрани, нервната система, сърцето, белите дробове, бъбреците и други органи и системи. От най-голямо значение при лечението на SLE е преднизонът, който има сравнително нисък страничен ефект. Триамцинолон и дексаметазон трябва да се предписват на пациенти с относителна резистентност към преднизон или, ако е необходимо, да се използва характеристиката на тяхното действие. Например триамцинолонът е показан за тежък оток и пълна болест, тъй като има способността да намалява отока и не причинява наддаване на тегло, характерно за преднизолон. Дълги месеци и много години лечение тези лекарства са били неподходящи поради развитието на тежка миопатия, която причинява триамцинолон, бързото начало на синдрома на Иценко-Кушинг и артериалната хипертония, които се появяват по време на приема на дексаметазон.
Ефективността на лечението на SLE зависи от това как индивидуално се избират началните потискащи дози кортикостероидни лекарства. Изборът на лекарството и неговата доза се определят от: 1) тежестта на курса - най-високите дози при остро протичане и обостряне на подовия курс; 2) активността на патологичния процес: 40-60 mg преднизон на ден за III степен, 30-40 mg на ден за II степен и 15-20 mg на ден за степен 1; 3) преобладаващата патология на органите (особено потискащата хормонална терапия трябва да бъде с лупус нефрит и увреждане на нервната система); 4) свързана с възрастта реактивност - в юношеството и менопаузата бързо се появяват раздразнителност, безсъние и други странични ефекти. Първоначалната доза глюкокортикостероиди трябва да е достатъчна, за да потисне надеждно активността на патологичния процес. Лечението с глюкокортикостероиди в максимална доза се провежда до изразен клиничен ефект (според показателите за клинична и лабораторна активност). След достигане на ефекта дозата на хормоналните лекарства се намалява бавно, като се фокусира върху предложената схема, за да се предотврати синдромът на „отмяна или намаляване на дозата“, но спазването на същото. принципа на индивидуализацията (табл. 3).
Таблица 3. Приблизителна схема за намаляване на дозата на преднизон при постигане на терапевтичен ефект
|
Mg преднизолон |
||||||||
Глюкокортикостероидите се предписват в комбинация с калиеви препарати, витамини, плазмени и кръвни преливания, а при необходимост с анаболни лекарства и други симптоматични средства (диуретици, хипотензивни средства, АТФ, кокарбоксилаза и др.). При остър и подостър курс на SLE от III степен на активност, разпространение на бъбречна патология (нефротични и нефритни синдроми) или на централната нервна система, както и при наличие на признаци на тежка лупус криза, глюкокортикоидите трябва да се прилагат в големи дози от самото начало (40-60 mg преднизон или преднизолон, 32 -48 mg триамцинолон, 6-9 mg дексаметазон). Ако състоянието на пациента не се подобри в рамките на 24-48 часа, тогава дозата на лекарството се увеличава с 25-30%. Големите дози кортикостероиди дават поне 1-1,5 месеца (а при лупус нефрит - 3 или повече месеца), след това дозата се намалява бавно според препоръчителната схема. С намаляване на дозата трябва да се добавят хинолин и други средства. През последните години, при SLE от III степен на активност, особено с тежко увреждане на бъбреците и централната нервна система, потискащата терапия започва с интравенозната употреба на големи дози метилпреднизолон - пулсотерапия (1 g на ден в продължение на 3 дни), след което преминава към гореописаната схема на супресивна терапия. Пулсовата терапия се понася добре от пациентите; нежеланите реакции (зачервяване на лицето, повишено кръвно налягане, известно възбуда) бързо преминават след края на венозната инфузия.
При умерена активност на SLE (II степен) в началото на подовия курс или след лечение с III степен на активност, дозите кортикостероиди трябва да бъдат по-малки (преднизон 30-40 mg, триамцинолон 24-32 mg, дексаметазон 3-4 mg на ден).
При минимална активност на SLE (степен I) обикновено 15-20 mg преднизон или друго лекарство в еквивалентна доза (12-16 mg триамцинолон, 2-3 mg дексаметазон) обикновено са достатъчни за получаване на положителен резултат; след това дозата постепенно се намалява до поддържаща. Лечението с кортикостероидни лекарства като правило не може да бъде напълно отменено поради бързо развиващото се влошаване на състоянието, следователно е важно поддържащата доза да е минималната, необходима за контролиране на болестното състояние. Поддържащата доза на кортикостероидите обикновено е 5-10 mg, но може да бъде и по-висока.
При много пациенти се развиват странични ефекти като кушингейд, хирзутизъм, екхимоза, стрии, акне, но те не изискват значителна допълнителна терапия. Следните усложнения са по-опасни: стероидна язва, обостряне на фокална инфекция, нарушен минерален метаболизъм, психоза и т.н. Така че, за да се предотврати развитието на пептични язви, на пациентите се препоръчва редовно хранене; необходимо е да се изключат остри, досадни ястия; храната трябва да бъде механично щадяща; препоръчително е да се използват алкализиращи средства, особено с развити диспептични симптоми, и спазмолитици (папаверин, ношпа и др.). При наличие на фокална стрепто - и стафилококова или туберкулозна инфекция, анти-инфекциозната терапия трябва да бъде включена в комплексното лечение. При предписване на антибиотици е необходимо да се контролира чувствителността на микробната флора и поносимостта на лекарствата към пациентите. Ако при пациента се открие фокална туберкулоза, кортикостероидните хормони трябва да се предписват в комбинация с противотуберкулозни лекарства (изотиазид, стрептомицин и др.). Развитата локална (млечница, пиелит) или обща (сепсис) кандидоза не е противопоказание за продължаване на глюкокортикоидната терапия, ако приемате нистатин 500 000 единици 3-6 пъти на ден или леворин 500 000 единици 4-6 пъти на ден в продължение на 7 дни и още под контрола на общото състояние на пациентите, екскреция в скрап, култури кандида, реакции на аглутинация и утаяване с антиген. В случай на инфекциозни усложнения, дозата на кортикостероидните лекарства не само не трябва да се намалява, но във връзка с временно потискане на функцията на надбъбречната кора при някои пациенти, с надеждна антиинфекционна защита, дори да се увеличи.
За да се предотвратят смущения в минералния и воден метаболизъм (отделяне на калий, калций, фосфор и задържане на натрий и вода), често придружени от оток, е необходимо наблюдение на калия в кръвта. При хипокалиемия калиев хлорид се дава перорално 1–2 g 3-4 пъти на ден, след разтварянето му във вода, обикновено до 5 g на ден, или калиев ацетат (15% разтвор, 3-4 супени лъжици на ден).
Загубата на калций и фосфор от организма обикновено се проявява при SLE чрез дифузна остеопороза и затова са показани анаболни стероиди (например, неробол 5 mg 3-4 пъти на ден в продължение на 3-4 седмици и т.н.).
Определено противопоказание за продължаване на лечението с кортикостероиди е стероидната психоза или увеличените припадъци (епилепсия). Възбудата (безсъние, еуфория) не е индикация за спиране на лечението. Това състояние може да бъде спряно от успокоителни средства (валериана, момина сълза бромид в конвенционални дози), резерпин (0,25 mg 2-3 пъти на ден), хлорпромазин (0,025 g на нощ или като 2,5% разтвор от 1 ml интрамускулно).
Въпреки високата ефективност на глюкокортикостероидите, все още има случаи на тежки SLE, при които горната терапия е недостатъчна. На такива пациенти се предписват имуносупресори (виж) алкилиращи серии (циклофосфамид) или антиметаболити (азатиоприн).
Показания за използването на имуносупресори при SLE: 1) висока степен на активност на заболяването, включваща много органи и системи и c. характеристики на бъбреците (както с нефротичен, така и с нефритен синдром); бъбречният синдром заема специално място в показанията за имуносупресивна терапия; така, дори при липса на други клинични признаци на активност на SLE, увреждането на бъбреците изисква ранна, масивна и по-продължителна имуносупресивна терапия във връзка с автоимунния генезис на лупус нефрит, изразен от съпътстващи нарушения на хуморалния и клетъчния имунитет; 2) необходимостта от намаляване на "преобладаващата" доза кортикостероиди поради тежки странични ефекти (бързо значително покачване на тегло, хипертония, стероиден диабет, тежка остеопороза, спондилопатия и др.) Или поради индивидуални характеристики на пациентите (конституционно затлъстяване, юношеска и менопауза периоди).
Понастоящем циклофосфамид и азатиоприн (имуран) често се използват в дози от 1-3 mg / kg (обикновено от 100 до 200 mg на ден). През последните години, когато се провежда белодробна терапия с метипред, 1 g циклофосфамид се добавя в системата веднъж, след което пациентът се прехвърля на прием на азатиоприн. В този случай пациентите получават едновременно от 10 до 40 mg преднизон на ден (в случаите на дифузен гломерулонефрит с нефротичен синдром). Курсът на лечение с имуносупресори в болницата е 2-2,5 месеца, след това дозата се намалява до поддържаща (50-100 mg на ден) и лечението продължава амбулаторно с редовен мониторинг в продължение на много месеци (до 3 години).
Наблюденията показват, че от 3-4-тата седмица на лечение се наблюдава забележим ефект при използването на имуносупресори, което налага комбинация от цитотоксични имуносупресори с малки дози кортикостероиди, особено при остър полиартрит, ексудативен плеврит и перикардит, когато се налага бърз противовъзпалителен ефект. Комбинираната терапия ви позволява да постигнете положителен ефект с малки и средни дози кортикостероиди.
Имуносупресивните лекарства са ефективни при SLE в 40-80% от случаите, в зависимост от вида на заболяването и времето на лечение. Твърдо е установено, че при острия курс на SLE имуносупресорите трябва да се предписват възможно най-рано, като не се очаква ефектът от предишната масивна кортикостероидна терапия, особено в случаите на лечение на юноши и жени по време на менопаузата, при които "потискащата" масивна кортикостероидна терапия дава най-сериозните усложнения: спондилопатия с гръбначни фрактури, асептична некроза на главите на бедрената кост. На 3-4-тата седмица на лечение с имуносупресори общото състояние на пациента се подобрява, явленията на артрит, плеврит, перикардит, кардит и пневмонит отшумяват; малко по-късно (на 5-6-та седмица) СУЕ и други показатели за възпалителна активност, протеинурията се намалява; уринарната утайка се подобрява, нивото на серумния комплемент и неговият трети компонент (С3) се нормализира. Бавно и само при 50% от пациентите титърът на антителата към ДНК намалява и LE клетките изчезват. Лабораторните критерии за ефективност на терапията все още не са разработени ясно.
Устойчиво подобрение (намаляване на активността на заболяването с поне една стъпка, стабилизиране на лупус-нефрит, нормализиране на показателите за възпалителна активност, отчетливо намаляване на титрите на антителата към ДНК и изчезване на LE клетките) се наблюдава едва след 4-6 месеца терапия и болестта може да се изостри само след многомесечен курс на лечение в поддържащи дози. Следователно, диспансерното лечение на пациентите и наблюдението им със SLE е задължително.
Ясен критерий за ефективността на имуносупресивната терапия е изчезването на кортикостероидната резистентност: възможността да се намали дозата на кортикостероидите до минимум, който ви позволява да поддържате противовъзпалителен ефект, или възможността да прекратите напълно тези лекарства.
Страничните ефекти на имуносупресорите и техните усложнения са свързани с цитотоксичен ефект върху активно пролифериращи клетки като костен мозък, стомах и черва, космени фоликули, полови жлези и др. Намаляване на активността на имунокомпетентната система е придружено от потискане на имунитета и намаляване на устойчивостта към инфекции. Страничен ефект се проявява чрез инхибиране на хематопоезата (левкемия, неутропения, тромбоеритроцитопения), склонност към вторична инфекция, диспептични разстройства и др. Лекарството се отменя само с развитието на бактериална инфекция и тежка цитопения (брой на левкоцитите по-малко от 2,0 · 109 / l, брой на тромбоцитите по-малко от 100 0.109 / l). В случай на хематологични усложнения, едновременно с премахването на цитотоксичните лекарства, дозата на кортикостероидите трябва да се увеличи до 50-60 mg на ден, а понякога и повече, докато първоначалната кръвна картина не се възстанови. При инфекциозни усложнения се провежда активна антибиотична терапия. Други усложнения възникват с намаляване на дозата на имуносупресанта и назначаване на симптоматична терапия (дори след пълна алопеция, косата расте обратно).
Витамините C и B групи трябва да бъдат включени в комплексната терапия на пациенти със SLE с курсове с продължителност 2-3 месеца, особено в периоди на тежък витаминен дефицит (зима, пролет), както и по време на обостряне на заболяването, ако е необходимо, увеличете дозите на хормоните. Предпишете 6% разтвор на витамин В1 по 1 мл дневно (30-40 инжекции), 2,5% (20 инжекции) или 5% (10 инжекции), разтвор на витамин В6 по 1 мл всеки ден, редувайки се с витамин В12, 200 μg ( 20 инжекции). Витамин В2 (рибофлавин) се дава през устата по 0,02 g 3 пъти на ден в продължение на 1 месец, особено при развитието на арибофлавиноза (ъглова стоматит, малинов език и др.).
Поради факта, че при редица пациенти за дълго време се забелязват болки в ставите и ограничено движение (главно поради сублуксации), когато активният висцерит затихва, може да се използва терапевтична терапия и масаж под контрола на общото състояние и състоянието на вътрешните органи.
Не се препоръчва физиотерапевтично и спа лечение за SLE. Често появата на болестта или нейното обостряне се провокира от UV облъчване на ставите, използване на радонови вани и инсолация.
предотвратяванеЦели да предотврати:
1) обостряния и прогресиране на заболяването и
2) появата на болестта.
За да се предотврати прогресията на SLE се провежда навременна адекватна, рационална комплексна терапия, тъй като само с ранно лечение с кортикостероиди в дози, съответстващи на активността на заболяването, е възможно да се предотврати увреждане на бъбреците и централната нервна система, което несъмнено подобрява прогнозата. На първо място, пациентът трябва да бъде убеден в целесъобразността на продължителното продължително лечение и спазването на следните инструкции:
1) своевременно се консултирайте с лекар, когато се чувствате по-добре, редовно се подлагайте на медицински преглед;
2) приемайте хормонални лекарства в строго предписана доза;
3) спазвайте ежедневието, включително 1-2 часа сън през деня и диета с ограничение на сол и въглехидрати, богати на протеини и витамини;
4) не се слънчеви бани, не преохлаждайте;
5) да се избягват различни хирургични интервенции, ваксинации, въвеждане на ваксини, серуми (само за показания през целия живот);
6) спазвайки защитния режим, не забравяйте за внимателно, изключително важно закаляване: сутрешни упражнения, избърсване с топла вода, дълги разходки на чист въздух, неуморни спортове;
7) при обостряне на фокални или интеркурентни инфекции, задължителната почивка в леглото, антибиотици, десенсибилизираща терапия са задължителни. Лечението на фокалната инфекция трябва да бъде упорито, предимно консервативно. Само когато е абсолютно необходимо, е възможно операция с използване на повишени дози глюкокортикостероиди и антибиотици;
8) на пациенти с кожни лезии, за да се предпазят от слънчева светлина, се препоръчва да смазват лицето, преди да излязат с крем Луч или фотозащитни мехлеми, да използват фотозащитен филм, прах със салол. При зачервяване на лицето, смажете кожата с глюкокортикостероидни мехлеми (преднизон, дексаметазон).
Препоръчително е да се препоръча на пациентите да водят дневник за доброто състояние и дозите на лекарствата, които използват. Във всеки случай лекарят трябва да напише стъпка по стъпка епикриза с подробно описание на състоянието на пациента през годината: наличието на обостряния, минали интеркурентни инфекции и стресови ситуации, увреждане, промени в лечението, данни от клинични и лабораторни изследвания. По време на хормоналното лечение всички пациенти трябва постоянно да се наблюдават от лекар. Когато се постигне пълна ремисия, глюкокортикостероидите се отменят, но пациентите трябва да бъдат проследявани още 2-3 години. Пациентите получават антирецидивно лечение (хинолин и антихистамини, витамини интрамускулно и през устата) - 1 път годишно, през есенно - пролетния период.
За първичната профилактика на заболяването, както при ревматизма, трябва да се разграничи група от „застрашени“. На първо място е необходимо да се изследват роднините на пациенти със SLE. Ако те разкрият дори един от следните симптоми - персистираща левкопения, увеличаване на СУЕ, хипергаммаглобулинемия, наличие на антитела срещу ДНК и др. - трябва да се препоръчва същият защитен режим, както при пациенти със SLE. Тези лица също трябва да избягват прекомерното излагане на слънце, хипотермия; те са противопоказани инокулации, кална терапия и др.
Особено внимание трябва да се обърне на пациенти с изолирани кожни лезии (дискоиден лупус). В тези случаи, за да се предотврати генерализирането на процеса, не може да се провежда UV-облъчване, лечение със златни препарати, спа лечение и др.
перспективаКогато SLE се подобри значително през последните години. С ранно разпознаване и адекватно системно лечение е възможно да се постигне ремисия при 90% от пациентите и да се удължи продължителността на живота в продължение на много години. Въпреки това, при 10% от пациентите, особено с ранен лупус нефрит, прогнозата остава неблагоприятна.
За лечение на SLE се използват следните:
1. Основните методи на патогенетичната терапия,
2. Методи за интензивна грижа,
3. Допълнителни методи на патогенетична терапия,
4. Спомагателни средства.
За повечето пациенти със SLE съвременната терапия може да намали общите признаци на системно възпаление, да потисне повечето симптоми и синдроми, да възстанови функцията на отделните органи и системи.
Целта на лечението трябва да бъде постигане на индуцирана ремисия, което предполага липсата на каквито и да било клинични прояви на SLE (докато може да има признаци, възникнали в резултат на лезии на определен орган или система при предишни обостряния), липса на цитопеничен синдром и имунологични изследвания показват минимални титри на антинуклеарни антитела. или не са определени.
А. Оценка на дейността на SLE:
1. Оценка на цялостната активност на заболяването: SLAM, SLEDAL скали (оценка въз основа на тежестта на клиничните прояви и лабораторните данни)
2. Активността на нефрит се оценява, като се вземат предвид: нивото на дневна протеинурия, уринен утайка, гломерулна филтрация.
Б. Оценка на увреждане на вътрешните органи и системи:
1. Индекс на щетите SLICC / ACR Damage Index (оценка за тежестта на признаците на заболяването)
2. Увреждане на бъбреците: прогресията на нефрита до стадия на хронична бъбречна недостатъчност, изискваща диализа; удвояване на серумния креатинин, хроничен индекс за хистологично изследване на бъбречната тъкан.
Б. Оценка на нежеланите реакции на лекарствата.
Основните лекарства за лечение на SLE
глюкокортикостероидиза орално и венозно приложение
имуносупресори
Производни на аминохинолин
Glyukokortikoвteroidyабсолютно показано с:
Висока възпалителна активност,
Увреждане на вътрешните органи, предимно нефрит,
ЦНС лезии
Хематологични нарушения.
Най-често използваните лекарства в ревматологичната практика са: преднизон, метилпреднизолон, дексаметазон, поликортолон.
Назначаването на адекватна доза НА позволява да потиснете повечето симптоми на заболяването след 2-3 седмици от началото на терапията. Освен това първоначалната доза на НА трябва да бъде най-малко 40-60-80 mg преднизолон на ден - от 0,75 до 2 mg / (kg на ден). Назначаването на по-малка доза от лекарството, дори и с неизразени прояви на SLE, не позволява да се постигне положителен резултат. При активен курс на лупус могат да се използват и по-високи дози преднизолон (80-120 mg). Най-ефективно е използването на НА вътре, а дозата през деня се разпределя по следния начин: сутрин 2/3 от избраната доза, а вечер 1/3. Веднага след като се наблюдава регресия на основните симптоми на заболяването, дозата на НА започва да се намалява, но постепенно, като правило, 1/2 таблетка се отменя седмично. Дългосрочното прилагане на поддържащи дози на НА (обикновено 5-15 mg преднизон на ден) осигурява клинична и лабораторна ремисия на заболяването в продължение на много месеци и дори години. Въпреки това, при лечението на леки форми на SLE, HA може да не се използва.
Много странични ефекти на НА са добре известни. Най-често и по-рано от всички могат да се появят оплаквания от стомашно-чревния тракт - болка в горната част на корема поради развитие на гастрит, дуоденит. HA може да причини язва на лигавицата на стомаха или дванадесетопръстника. В тази връзка на пациентите се препоръчва да приемат НА след хранене и да пият таблетки с мляко или желе. Ако следвате тези прости правила, рискът от развитие на язви е значително намален. Стомашно-чревните язви могат да се превърнат в източник на вътрешно кървене. В такива ситуации се наблюдават течни кафяви изпражнения, което изисква незабавна медицинска помощ.
На фона на продължително прилагане на НА, синдромът на Itenko-Cushing може да се развие, когато има селективно повишено отлагане на мазнини в тазовия пояс и по лицето в бузите, докато лицето придобива лунна форма. По страничните повърхности на корема се появяват розови или синкаво оцветени белези, така наречените стрии, поради пренатягане на кожата.
При възрастни хора и хора на средна възраст приемането на НА може да доведе до развитие на стероиден диабет. В зависимост от нивото на хипергликемия се препоръчва диета с ограничаване на храни, съдържащи рафинирани въглехидрати или допълнително предписване на перорални хипогликемични лекарства. По правило преминаването към поддържащи дози на НА допринася за нормализиране на кръвната захар.
Известно е, че глюкокортикоидите причиняват остеопороза, когато възникне костна загуба и рискът от фрактура се увеличава. Това усложнение може да се избегне, ако с цел предотвратяване на остеопения, едновременно с прилагането на НА, човек започне да приема комбиниран калций и витамин D.
Аминохинолинови препарати
Хидроксихлорохин (Plaquenil)това е лекарството по избор при лечението на SLE, протичащо без увреждане на жизненоважните органи. Първоначалната доза от 400 mg на ден има добър ефект върху обратното развитие на симптоми като умора, артралгия и кожни лезии. Въпреки това, хидроксихлорохинът помага за намаляване на триглицеридите и VLDL. Необходимо е тримесечно да се контролират пациентите с помощта на прореза с лампа.
Цитотоксични имуносупресори
При липса на очаквания ефект от използването на НА на фона на прогресиране на заболяването, с увреждане на жизненоважни органи (сърце, бъбреци, бели дробове, централна нервна система) възниква въпросът за назначаването на лекарства от втора линия при лечение на SLE - цитостатични имуносупресори. Цитостатици като азатиопринили имуран, циклофосфамид(1-2,5 mg на kg телесно тегло на ден). По време на терапията с тези лекарства подобрението се наблюдава при повече от половината пациенти със SLE. Лечението с имуносупресори дава по-добри резултати, ако се комбинира с НА.
Текат дискусии относно ефективността на преднизона в опцията за монотерапия, преднизон в комбинация с циклофосфамид или азатиоприн при лупус нефрит. В момента с III и IV морфологични класове на лупус гломерулонефрит се счита за препоръчително да се използва метилпреднизолонвъв връзка с циклофосфамид.Освен това циклофосфамидът трябва да се прилага ежемесечно под формата на пулсова терапия в доза 1,0 g интравенозно през първите 6 месеца. Впоследствие, когато се постигне ремисия, циклофосфамидът се прилага по-рядко (веднъж на 2-3 месеца).
Трябва да се помни, че при лечението на цитостатици са възможни различни усложнения - развитие на левкопения, агранулоцитоза, анемия, тромбоцитопения. Всички тези прояви са свързани с токсичния ефект на тази група лекарства върху кръвообразуващите органи. Необходим е внимателен хематологичен мониторинг - по-специално, кръвен тест веднъж на 3-4 седмици. Основният начин за спиране на тези нежелани реакции е временно прекратяване на лекарството или намаляване на дозата.
През последните години редица клинични проучвания за употребата на микофенолатен мофетилпри лечение на лупус нефрит. Също така ефикасността на микофенолат мофетил е доказана при група пациенти със СЛЕ с други извънренални симптоми на заболяването. Основният ефект на лекарството е свързан с блокада в синтеза на гуанозин, което води до инхибиране на пролиферацията на Т и В лимфоцитите. Лекарството се предписва 1000 mg 2 пъти на ден. За разлика от други цитостатици, микофенолатният мофетил се понася по-добре.
При липса на признаци на увреждане на бъбреците е възможно да се използва iU-totreksataв малки дози (7,5-15 mg седмично). Метотрексат може да се използва и ако няма ефект от антималарийните лекарства.
Окуражаващите резултати от лечението на SLE са получени с помощта на имуносупресори от нецитотоксична серия - циклоспорин А,който се предписва в доза 2,5-3 mg / (kg на ден) през устата в продължение на 6 месеца. Употребата му обаче може да бъде ограничена при развитието на артериална хипертония поради нефропатия.
Лечение на активни форми на SLE
Лечебните програми за активни форми на SLE имат свои собствени характеристики във връзка с по-агресивен ход на заболяването, което е придружено от:
1) прогресивен курс с развитие на нови симптоми и синдроми, въпреки използването на високи дози НА на 1-1,5 месеца; 2) лупус нефрит с образуването на нефротичен синдром;
3) тежко увреждане на централната нервна система (остра психоза, поява на фокални симптоми, напречен миелит, статус епилептик);
4) развитието на животозастрашаващи усложнения (перикарден излив, пневмонит с нарастваща дихателна недостатъчност, повтаряща се тромбоза и др.).
За да се получи терапевтичен ефект при лечението на пациенти със SLE с висока активност, преднизолонв доза 2-3 mg / kg телесно тегло на ден през устата, последвано от намаляване.
Използването на високи дози метилпреднизолонинтравенозно (по 1,0 g всеки) за три до пет дни подред става стандартният режим на лечение за пациенти с остър активен лупус. Когато се постигне подобрение след пулсова терапия, са възможни повторни курсове (веднъж метилпреднизолон венозно до 1 g) на всеки 3-4 седмици в продължение на 18 месеца. С прогресията на нефрит или васкулит е необходимо допълнително приложение циклофосфамидв доза от 1000 mg интравенозно през първия или последния ден от пулсовата терапия на НА.
Инфузията на лекарства се извършва на физиологичен разтвор бавно - за период от 30 минути до час. Освен това в някои случаи подобна терапия може да се провежда в амбулаторни условия, при условие че пациентът се наблюдава в продължение на 2-3 часа.
Някои изследователи показват, че интравенозната употреба на по-ниски дози метилпреднизолон (500 mg) в някои случаи не отстъпва на ефективността на високите дози. Тази разпоредба обаче не се прилага за лечението на лупус нефрит. Ефективността на преднизолон перорално във високи дози е сравнима с интравенозна пулсова терапия, но е много по-евтина и не изисква хоспитализация в някои случаи.
Високи дози имуноглобулини.
Обикновено венозното приложение на високи дози имуноглобулин се използва при тежка тромбоцитопения или имунна неутропения, както и при катастрофичен антифосфолипиден синдром. Ефективността на употребата на имуноглобулини при "нехематологични" прояви на SLE все още е съмнителна.
Допълнителни методи на патогенетична терапия на SLE
Екстракорпорални лечения за SLE.
През последните години в комплексното лечение на SLE широко се използват ефективни методи на терапия: плазмафереза, лимфоцитофереза, хемосорбция и др. Методите на сорбция и афереза \u200b\u200bви позволяват да премахнете от тялото продукти на метаболизма на клетки, антитела, имунни комплекси, които могат да се утаяват по стените на кръвоносните съдове и да причинят възпаление. Важен фактор при екстракорпоралните методи за пречистване на кръвта е повишаването на чувствителността на организма към лекарства и преди всичко НА. Плазмаферезата или плазменият обмен са се доказали в лечението на SLE, което протича с криоглобулинемия, автоимунна тромбоцитопенична пурпура и DIC.
Когато планирате индивидуална терапия, човек трябва да вземе предвид естеството на лупусния процес, участието на жизненоважни органи, заплахата от усложнения, степента на активност на имуно-възпалителния процес. Лекарят трябва да помни, че лечението на SLE не се ограничава до използването на НА и цитостатици. В таблицата. са посочени групи лекарства, които могат да се използват при лечението на отделни симптоми на заболяването, както и възможността за използване на физиотерапия и допълнителна терапия за някои прояви на SLE.
Планиране на лечение за основни клинични прояви на SLE
|
SLE прояви |
аналгетици |
Стероиди на местно ниво |
Съдови препарати |
Аминохинолинови лекарства |
Глюкосериите кортико-Ида |
цитостатици |
физиотерапия |
Адюнктивна терапия |
|
|
артралгия | |||||||||
|
синовит | |||||||||
|
тендинит | |||||||||
|
вазоспазъм | |||||||||
|
изскимтя | |||||||||
|
тромбоза | |||||||||
|
serozity | |||||||||
|
пневмония | |||||||||
|
невропатия | |||||||||
|
Цереброваскуларно заболяване | |||||||||
|
конвулсии | |||||||||
|
цитопения | |||||||||
|
Синдром на сухота | |||||||||
|
фотосенсибилизация |
Симптоматична терапия
Нестероидните противовъзпалителни средства са добро допълнение към НА, когато се появи умерена артралгия или дозата е намалена.
Изолираните припадъци се лекуват с антиконвулсанти. Освен това в някои случаи не е необходимо да увеличавате дозата на кортикостероидите.
Когато се открие хроничен DIC синдром, както и тенденция към рецидивираща тромбоза, е показана продължителна терапия с директни антикоагуланти (хепарин, фраксипарин).
K допълваща терапиявключват антидепресанти, лекарства за лечение на мигрена, фенотиазини.
При лечението на автоимунна тромбоцитопения гамаглобулин се използва интравенозно.
Обсъжда се ефективността на спленектомия при тежка тромбоцитопения при пациенти със SLE.
Блокерите на калциевите канали (нифедипин) се използват при лечението на синдрома на Рейно.
С развитието на тежка тъканна исхемия са показани вазодилататори с антитромботичен потенциал (интравенозен простациклин).
предотвратяване
Превантивни мерки, насочени към предотвратяване на обостряния:
За пациенти с фотосенсибилизация трябва да се избягва пряка слънчева светлина;
Редовните упражнения могат да намалят мускулната слабост;
Избягвайте пушенето, злоупотребата с алкохол.
Lupus ЧЕРВЕНА СИСТЕМА - хронично полисиндромно заболяване на съединителната тъкан и кръвоносните съдове, развиващо се във връзка с генетично причинено несъвършенство на имунорегулаторните процеси.
Етиология. Предполага се значението на вирусна инфекция на фона на генетично обусловени имунни нарушения.
патогенеза: образуването на циркулиращи автоантитела, от които антинуклеарните антитела имат най-важно диагностично и патогенетично значение; образуването на циркулиращи имунни комплекси, които, отложени върху базапарните мембрани на различни органи, причиняват тяхното увреждане и възпаление. Такава е патогенезата на нефрит, дерматит, васкулит и др. Тази хиперреактивност на хуморалния имунитет е свързана с нарушена клетъчна имунорегулация. Напоследък се придава значение на хиперестрогенемията, придружена от намаляване на клирънса на циркулиращите имунни комплекси и др. Доказано е семейно-генетично предразположение. Заболяват предимно млади жени и тийнейджъри. Провокиращите фактори са: инсолация, бременност, аборт, раждане, началото на менструалната функция, инфекция (особено при юноши), лекарствена реакция или реакция след ваксинация.
Симптоми, разбира се. Заболяването започва постепенно с повтарящ се полиартрит, астения. По-рядко е острото начало (висока температура, дерматит, остър полиартрит). В бъдеще се отбелязва рецидивиращ курс и характерен полисиндромизъм.
Полиартрит, полиартралгия - Най-честият и ранен симптом на заболяването. Засягат се предимно малки стави на ръцете, китката, глезена и по-рядко коленните стави. Неерозивният тип полиартрит е характерен дори при наличие на деформация на междуфаланговите стави, която се развива при 10-15% от пациентите с хроничен ход. Еритематозните обриви по кожата на лицето под формата на "пеперуда", в горната половина на гърдите под формата на "деколте", по крайниците също са често срещан признак на системен лупус еритематозус. Полисерозитът се счита за компонент от диагностичната триада, заедно с дерматит и полиартрит. Той се наблюдава при почти всички пациенти под формата на двустранен плеврит и (или) перикардит, по-рядко перихепатит и (или) периспланит.
Характерно е поражението на сърдечно-съдовата система. Обикновено се развива перикардит, към който се присъединява и миокардитът. Сравнително често се наблюдава брадавичен ендокардит на Либман - Сакс с лезии на митралната, аортната и трикуспидната клапа. Признаци за съдово увреждане са включени в картината на увреждане на отделните органи. Независимо от това, трябва да се отбележи възможността за развитие на синдрома на Рейно (много преди типичната картина на заболяването), поражението както на малки, така и на големи съдове със съответните клинични симптоми.
Белодробни лезии може да бъде свързано с основното заболяване под формата на лупус пневмонит, характеризиращ се с кашлица, задух, нечуваеми влажни хрипове в долните части на белите дробове. Рентгеново изследване при такива пациенти разкрива увеличаване и деформация на белодробния модел в базалните части на белите дробове; на моменти могат да се открият фокални тонове. Тъй като пневмонитът обикновено се развива на фона на текущия полисерозит, описаните радиологични симптоми се допълват от високо изправяне на диафрагмата с признаци на плевродиафрагмално и плевроперикардиално сливане и дискообразна ателектаза (линейни сенки, успоредни на диафрагмата).
При изследване на стомашно-чревния тракт се отбелязват афтозен стоматит, диспептичен синдром и анорексия. Синдромът на коремна болка може да бъде свързан както с участието на перитонеума в патологичния процес, така и със самия васкулит - мезентериален, слезен и др. Сегментарният илеит се развива по-рядко. Поражението на ретикулоендотелната система се изразява в увеличаване на всички групи лимфни възли - много чест и ранен признак на системно заболяване, както и увеличаване на черния дроб и далака. Всъщност лупусният хепатит се развива изключително рядко. Увеличаването на черния дроб обаче може да се дължи на сърдечна недостатъчност с панкреатит или тежък изливен перикардит, както и на развитието на мастен черен дроб.
Лупус еритематозен гломерулонефрит (лупус нефрит) се развива при половината от пациентите, обикновено по време на генерализацията на процеса. Има различни варианти за увреждане на бъбреците - уринарен синдром, нефрит и нефротично. За разпознаването на лупус нефрит е от голямо значение интравитална пункционна биопсия с имуноморфологично и електронно микроскопско изследване на бъбречната биопсия. Развитието на бъбречна патология при пациенти с рецидивиращ артикуларен синдром, висока температура и трайно повишен СУЕ изисква изключване на лупус нефрит. Трябва да се помни, че почти всеки пети пациент с нефротичен синдром има системен лупус еритематозус.
Поражението на невропсихичната сфера Той се среща при много пациенти във всички фази на заболяването. В началото на заболяването - астеновегетативен синдром, по-късно се развиват признаци на увреждане на всички части на централната и периферната нервна система под формата на енцефалит, миелит, полиневрит. Характерно е увреждането на нервната система под формата на менингоенцефаломиелополирадикулоневрит. По-рядко наблюдавани епилептиформни припадъци. Възможни са халюцинации (слухови или зрителни), налудни състояния и др.
Лабораторните данни имат диагностична стойност: определяне на голям брой LE-клетки, високи титри на антитела към ДНК, особено на нативната ДНК, към дезоксирибонуклеопротеин, Sm-антиген.
В острия курс, след 3-6 месеца, лупусният нефрит често се открива като нефротичен синдром. В подострото протичане се различава вълнообразно с ясно засягане на различни органи и системи и характерен полисиндромизъм. Хроничният ход на заболяването за дълго време се характеризира с редициди на полиартрит и (или) полисерозит, синдроми на лупус еритематозус, Рейно; едва на 5-10-та година постепенно се развива характерен полисиндромизъм. В съответствие с клиничните и лабораторните характеристики се разграничават три степени на активност на процеса; висока (III степен), умерена (II степен) и минимална (I степен).
Лечение. Пациентите се нуждаят от продължително многогодишно комплексно лечение. Най-добрите резултати с развитието на персистираща клинична ремисия са с ранно лечение. При хроничен и подостър курс и I степен на активност са показани нестероидни противовъзпалителни средства и аминохинолинови производни. Първите се препоръчват при ставен синдром. Изборът на лекарството е важен, като се вземе предвид неговата индивидуална ефективност и поносимост: волтарен (ортофен) 50 mg 2-3 пъти на ден, индометацин 25-50 mg 2-3 пъти на ден, бруфен 400 mg 3 пъти на ден, хингамин (хлорохин, делагил) 0,25-0,5 g / ден в продължение на 10-14 дни, а след това 0,25 r / ден в продължение на няколко месеца. С развитието на дифузен лупус нефрит плакенил 0,2 г 4-5 пъти на ден се използва успешно за дълго време под контрола на динамиката на синдрома на урината.
При остър курс от самото начало и при подостър и хроничен курс с III, II степен на активност на патологичния процес са показани глюкокортикостероиди .. Първоначалната доза на тези лекарства трябва да е достатъчна, за да потисне надеждно активността на патологичния процес. Преднизолон в доза 40-60 mg / ден се предписва за остър и подостър курс с III степен на активност и наличие на нефротичен синдром или менингоенцефалит. При същите варианти на курса с II степен на активност, както и при хроничен курс с III и II степен на активност, потискащата доза трябва да бъде 30-40 mg, а с I степен на активност - 15-20 mg / ден. Лечението с преднизолон в огромна доза се провежда преди появата на изразен клиничен ефект (според намалението на показателите за клинична и лабораторна активност). След достигане на ефекта дозата на преднизон се намалява бавно, като се фокусира върху предложената схема (табл. 7).
Таблица 7. Приблизителна схема за намаляване на дозата на преднизон при постигане на терапевтичен ефект
| доза | седмица | ||||||
| преднизон mg | 1-ви | трета | 4-ти | 5-ти | 6-ти | 7-ми | 8-ми |
| 75 | 70 | 60 | 50 | ||||
| 50 | 47,5 | 45 | 42,5 | 42,5 | 40 | ||
| 40 | 37,5 | 35 | 35 | 32,5 | 32,5 | 30 | 30 |
| 30 | 27,5 | 25 | 25 | 22,5 | 22,5 | 29 | 20* |
| * На следващо място, много бавно - половин таблетка (2,5 mg) след 1-3 месеца (според индикатори за общо състояние и данни от лабораторни изследвания). | |||||||
Една от най-важните задачи и ключът към ефективността на терапията е подборът на най-ниската доза, която ви позволява да поддържате клинична и лабораторна ремисия. Преднизолон в поддържаща доза от 5-10 mg / ден се предписва в продължение на няколко години.
За да се намали страничният ефект на гпкокортикоидите, се препоръчва тази терапия да се комбинира с калиеви препарати, анаболни стероиди, диуретици и антихипертензивни лекарства, транквиланти, антиулцерни мерки. Най-сериозните усложнения: стероидна язва, септични инфекции, туберкулоза, кандидоза, психоза.
При агресивен ход на заболяването успешно се използва висок титър на автоантитела, имунни комплекси, плазмафереза.
Ако глюкокортикоидите са неефективни, се предписват имуносупресори (алкилиращи серии или азатиоприн). Показания за назначаване на цитотоксични лекарства (обикновено в комбинация с умерени дози кортикостероиди) са следните:
1) 1 степен на активност при подрастващите и в менопаузата;
2) нефротични и нефритни синдроми;
3) необходимостта от бързо намаляване на прекомерната доза преднизон поради тежестта на страничните ефекти (бързо и значително увеличаване на телесното тегло, прекомерна артериална хипертония, стероиден диабет, тежка ос-теопороза с признаци на спондилопатия);
4) необходимостта от намаляване на поддържащата доза на преднизон, ако надвишава 15-20 mg / ден.
Най-често използвани са азатиоприн (имуран) и циклофосфамид (циклофосфамид) в доза 1-3 mg / kg (100-200 mg / ден) в комбинация с 30 mg преднизолон. При тази доза лекарството се предписва за 2-2,5 месеца, обикновено в болница, след това се прилага поддържаща доза (50-100 mg на ден), която се прилага в продължение на няколко месеца или дори 1-2 години или повече.
За да се гарантира безопасността на лечението, е необходимо внимателно проследяване на кръвния тест за предотвратяване на панцитопения; необходимо е да се избягва закрепването на инфекциозни усложнения, диспептични усложнения; когато приемате циклофосфамид, рискът от развитие на хеморагичен цистит може да бъде намален чрез предписване на много вода (2 литра течност или повече на ден).
Тъй като пациентите се нуждаят от дългосрочно лечение след изписване от болницата, те трябва да бъдат под наблюдението на лекар или ревматолог в клиниката. За да се подобри поносимостта на продължителната кортикостероидна терапия в амбулаторни условия, се препоръчва делагил при 0,25 g / ден и витамини от група В, аскорбинова киселина под формата на пролетно-есенния курс. На пациентите е показано лечение в санаториуми от местен тип (кардиология, ревматология). Климатично-балнеологичното, физиотерапевтичното лечение е противопоказано, тъй като ултравиолетовата радиация, инсолацията и хидротерапията могат да причинят обостряне на заболяването.
SCLEroderma системна -хронично системно заболяване на съединителната тъкан и малките съдове с общи фибросклеротични промени в кожата и стромата на вътрешните органи и симптоми на облитериращ ендартерит под формата на синдром на системния Рейно.
етиология неизвестен. Провокира се от охлаждане, травма, инфекция, ваксинация и др.
В патогенезата водещо значение има нарушение на метаболизма на колаген, свързано с функционалната хиперактивност на фибробластите и гладкомускулните клетки на съдовата стена. Също толкова важен фактор в патогенезата е нарушение на микроциркулацията поради увреждане на съдовата стена и промяна в интраваскуларните агрегатни свойства на кръвта. В определен смисъл системната склеродермия е типично колагеново заболяване, свързано с прекомерно образуване на колаген (и фиброза) на функционално дефектни фибробласти и други клетки, образуващи колаген. Семейно-генетичната предразположеност има значение. Жените се разболяват 3 пъти по-често от мъжете.
Симптоми, разбира се. Обикновено заболяването започва със синдром на Рейно (вазомоторни разстройства), трофични разстройства или постоянна артралгия, загуба на тегло, треска, астения. Започвайки с всеки един симптом, системната склеродермия постепенно или по-скоро бързо придобива чертите на мулти-синдромното заболяване.
Кожна лезия - патогномоничен признак на заболяването. Това е често срещано гъсто подуване, в бъдеще - уплътняване и атрофия на кожата. Най-големите промени претърпяват кожата на лицето и крайниците; често кожата на цялото тяло е гъста. В същото време се развива фокална или широко разпространена пигментация с области на депигментация, телеангиектазии. Характерни са улцерации и абсцеси на върха на пръстите, нелекуващи и изключително болезнени за дълго време, деформация на ноктите, косопад до плешивост и други трофични разстройства.
Често се развива фиброзиращ интерстициален миозит. Мускулният синдром е придружен от миалгия, прогресивно уплътняване, след това мускулна атрофия, намалена мускулна сила. Само в редки случаи се наблюдава остър полимиозит с болка, подуване на мускулите и др. Фиброзни промени в мускулите са придружени от сухожилна фиброза, което води до мускулно-сухожилни контрактури, една от причините за сравнително ранната инвалидност на пациентите. Увреждането на ставите е свързано главно с патологични процеси в периартикуларните тъкани (кожа, сухожилия, ставни торби, мускули). Артралгията се наблюдава при 80-90% от пациентите, често придружена от тежка деформация на ставите поради пролиферативни промени в периартикуларните тъкани; Рентгеновото изследване не разкрива значителни разрушения. Важна диагностична характеристика е остеолизата на терминала, а в тежки случаи - средните фаланги на пръстите, по-рядко краката. Отлагането на калциеви соли в подкожната тъкан се локализира главно в областта на пръстите и периартикуларните тъкани, изразено под формата на болезнени неравномерни образувания, понякога спонтанно отварящи се с отхвърляне на малки варовити маси.
Увреждане на сърдечно-съдовата система наблюдава се при почти всички пациенти: миокардът и ендокардът са засегнати, рядко перикард. Кардиосклерозата на склеродермията се характеризира клинично с болка в сърцето, задух, екстрасистола, заглушени тонове и систолно мърморене на върха, разширяване на сърцето вляво. При рентгеново изследване се отбелязва отслабване на пулсацията и гладкост на контурите на сърцето, с рентгенова дифракция - тъпи зони в области с голяма фокална кардиосклероза; а в най-тежките случаи се формира аневризма на сърцето във връзка с подмяната на мускулната тъкан с фиброзна тъкан. На ЕКГ обикновено се наблюдава понижение на напрежението, нарушения на проводимостта до атриовентрикуларен блок; сърдечен удар ЕКГ възниква с развитието на масивни огнища на фиброза в миокарда. Ако процесът е локализиран в ендокарда, е възможно развитието на сърдечна болест на склеродермия и увреждане на париеталния ендокард. Митралната клапа обикновено страда. Склеродермичната болест на сърцето се характеризира с доброкачествен ход. Сърдечната недостатъчност рядко се развива, главно с широко разпространено увреждане на сърдечния мускул или и на трите му мембрани.
Увреждане на малките артерии, артериолите причиняват периферна склеродермия симптоми като синдром на Рейно, гангрена на пръста. Увреждането на съдовете на вътрешните органи води до тежка висцерална патология - кръвоизливи, исхемични и дори некротични промени с клиничната картина на тежък висцерит (разлагане на белодробната тъкан, "истинския бъбречен склеродермия" и др.). Съдовата патология определя скоростта на процеса, неговата тежест и често изхода от заболяването. В същото време могат да бъдат засегнати големи съдове с клинична картина на tliteboangiitis obliterans; развиват се исхемични явления и често гангрена на пръстите на краката, мигриращ тромбофлебит със строфични язви на стъпалата и краката и др.
Увреждане на белите дробовепод формата на дифузна или фокална пневмофиброза, основно базалните части на белите дробове, обикновено се придружава от емфизем и бронхиектазии, а често и от адхезивен плеврит. Забелязват се недостиг на въздух, затруднено поемане на дълбоко дъх, трудно дишане, хрипове по време на аускултация на белите дробове, подобен на кутия сянка на звук от перкусия, намаляване на жизнения капацитет до 40-60% поради двустранно подсилване и деформация на белодробния модел, понякога с фина мрежа (пчелни пити); Рентгеново изследване - признаци, които обикновено характеризират склеродермална пневмофиброза. Увреждането на бъбреците най-често се проявява чрез фокален нефрит, но е възможен дифузен гломерулонефрит с хипертония и бъбречна недостатъчност. С бързо прогресиращия курс на системна склеродермия често се развива „истинският склеродермен бъбрек“, причинен от увреждане на кръвоносните съдове на бъбрека, което води до фокална некроза на кората и бъбречна недостатъчност. Поражението на хранопровода, изразяващо се с дисфагия, разширяване, отслабване на перисталтиката и скованост на стените с намаляване на преминаването на барий по време на рентгеново изследване, се наблюдава много често и има важна диагностична стойност. Често пептичните язви се образуват в долната част на твърдия хранопровод. Във връзка със съдови увреждания са възможни язви, кръвоизливи, исхемична некроза и кървене в храносмилателния тракт.
Увреждане на нервната система проявява се с полиневрит, автономна нестабилност (нарушение на изпотяване, терморегулация, вазомоторни кожни реакции), емоционална лабилност, раздразнителност, сълзливост и подозрителност, безсъние. Само в редки случаи се появява картина на енцефалит или психоза. Симптомите на склероза на мозъчните съдове са възможни във връзка с тяхното увреждане на склеродермия, дори при млади хора. Има лезия на ретикулоендотелиалната (попададения, а при някои пациенти хепатоспленомегалия) и ендокринни (плюригландуларна недостатъчност или патология на една или друга ендокринна жлеза).
По-често се провежда хроничен курс, заболяването продължава десетилетия с минимална активност на процеса и постепенното разпространение на лезиите в различни вътрешни органи, чиято функция не се нарушава дълго време. Такива пациенти страдат главно от увреждане на кожата, ставите и трофични заболявания. В рамките на хроничната системна склеродермия се разграничава синдром на KRST (калциноза, синдром на Рейно, склеродактилия и телеангиектазия), характеризиращ се с продължителен доброкачествен курс с изключително бавно развитие на висцерална патология. С подостър курс заболяването започва сартрагия, загуба на тегло, висцерална патология бързо се увеличава и болестта придобива постоянно прогресиращ курс с разпространението на патологичния процес към много органи и системи. Смъртта обикновено настъпва в рамките на 1-2 години от началото на заболяването.
Лабораторните данни не са характерни. Обикновено се наблюдават лека нормо- или хипохромна анемия, умерена левкоцитоза и еозинофилия, преходна тромбоцитопения. СУЕ е нормален или умерено повишен при хроничен ход и значително повишен (до 50-60 mm / h) при подостър.
лечение: използването на противовъзпалителни и общо укрепващи средства, възстановяване на загубените функции на опорно-двигателния апарат.
Активната противовъзпалителна терапия с кортикостероиди е показана главно в подостър курс или в периоди на изразена активност на процеса в хроничен курс. Преднизолон от 20-30 mg се прилага за 1-1,5 месеца, докато се постигне изразен терапевтичен ефект, след това той се намалява много бавно, поддържаща доза (5-10 mg преднизолон) се използва дълго време, докато се получи стабилен ефект. В периода на понижаване на дозите на хормонални лекарства могат да се препоръчат нестероидни противовъзпалителни средства. D-пенициламинът се предписва по 150 mg 3-4 пъти на ден с постепенно увеличение до 6 пъти на ден (900 mg) за дълго време, най-малко една година; особено показан за бързото прогресиране на заболяването; най-сериозното усложнение е нефротичен синдром, изисква незабавно прекратяване на лекарството; диспептичните разстройства намаляват с временно прекратяване на лекарството, промяна на вкуса може да се регулира чрез назначаването на витамин В6. Аминохинолиновите препарати са показани за всички варианти на курса. Делагил (0,25 г веднъж дневно) или плакенил (0,2 г 2 пъти на ден) могат да се предписват дълго време, през годините, особено при синдрома на водещата става.
През последните години широко се използват блокери на калциевите канали - коринфарум (нифедипин) при 30-80 mg / ден, в продължение на месеци с добра поносимост. С "истински склеродермичен бъбрек" - плазмафереза, продължителна употреба на каптоприл при 400 mg на ден (до 1 година или повече).
При хроничен курс се препоръчва лидаза (хиалуронидаза), под въздействието на която сковаността намалява и мобилността в ставите се увеличава, главно поради омекотяване на кожата и подлежащите тъкани. Лидаза се прилага всеки ден при 64 UE в 0,5% s / c разтвор на новокаин (12 инжекции на курс). След 1-2 месеца курсът на лечение с лидаза може да се повтори (само 4-6 курса годишно). С изразен ангиоспастичен компонент (синдром на Рейно) са посочени многократни курсове на ангиотрофин (1 ml sc, на курс от 30 инжекции), каликреин депо и инекалин (1 ml / m, на курс от 30 инжекции).
При всички варианти на хода на заболяването се препоръчва активна витаминна терапия, АТФ. При хроничен курс се посочват балнеотерапия (иглолистни, радонови и водородни сулфидни бани), парафинови и кални приложения, електрофореза на хиалуронидаза, приложения с 30-50% разтвор на диметил сулфоксид (20-30 сесии) върху засегнатите крайници. Терапевтичните упражнения и масажът са важни. В подостър курс се препоръчва сутрешна хигиенна гимнастика и активно положение в леглото, при хроничен курс постоянната и продължителна употреба на терапевтична гимнастика в комбинация с масаж и различни трудови процеси (извайване от топъл парафин, тъкане, триене и др.).
Системният лупус еритематозус е системно възпалително заболяване, свързано с производството на автоантитела и имунни комплекси към собствените тъкани на организма.
Преобладаващата възраст на заболяването е 20-40 години. Преобладаващ пол - женски
Причини за възникване на
Фактори на околната среда. Смята се, че вирусите, токсичните вещества и лекарствата могат да бъдат причина за развитието на системен лупус еритематозус. В редица случаи пациентите със системен лупус еритематозус имат антитела към вируса на Епщайн-Бар, известен е феноменът на молекулярно маскиране на автоантигени на лупус и вирусни протеини.
Хормонални влияния. Системният лупус еритематозус се развива главно при жени в детеродна възраст, но хормоналните фактори могат да имат по-голям ефект върху проявите на болестта, отколкото върху нейното начало.
Генетични характеристики. Ролята на генетичните фактори потвърждава връзката на системния лупус еритематозус с наследствен дефицит на отделни компоненти на имунната система.
Прояви на лупус
- Кожна лезия: дискоидна лезия - огнищата приличат на монети с червени ръбове, изтъняване в центъра и промяна в цвета. Зачервяване на кожата на носа и скулите като пеперуда (зачервяване на бузите и в задната част на носа). Свръхчувствителност към светлина - кожни обриви в резултат на необичайна реакция на слънчева светлина. Възможен е и косопад, уртикария.
- Увреждане на лигавиците: възпаление на лигавиците на устните, ерозия.
- Увреждане на ставите: болки в ставите.
- Увреждане на мускулите: болка, мускулна слабост.
- Увреждане на белите дробове - задух, болка по време на дишане.
- Поражението на сърцето.
- Увреждане на бъбреците.
- Главоболие, наподобяващо мигрена, което не отшумява след прием на болкоуспокояващи, разстройства на настроението.

диагностика
- Пълна кръвна картина
- Откриване на LE клетки в кръвта
Диагностични критерии на Американската ревматологична асоциация
Диагнозата на системния лупус еритематозус се счита за надеждна, ако има 4 или повече критерия (чувствителност - 96%, специфичност - 96%).
- Обрив по бузите: фиксирано зачервяване (плоско или повдигнато) на скулите, което има тенденция да се разпространява към носогубията.
- Дискоиден обрив: червени, нарастващи плаки с прилепнали кожни люспи.
- Фотодерматит: кожен обрив в резултат на необичайна реакция на слънчева светлина.
- Язви на устата: язви на устата или назофаринкса, обикновено безболезнени.
- Артрит (увреждане на ставите).
- Увреждане на бъбреците.
- Конвулсии: при липса на лекарства или метаболитни нарушения (уремия, кетоацидоза, електролитен дисбаланс).
- Психоза: при липса на лекарствени или електролитни нарушения.
- Хематологични нарушения: левкопения<4,0х10 9 /л (зарегистрированная 2 и более раз) или лимфопения <1,5х10 9 /л (зарегистрированная 2 и более раз) или тромбоцитопения <100х10 9 /л (не связанная с приемом лекарств).
- Анти-ДНК: антитела към нативната ДНК в повишен титър.
- Увеличение на титъра на антинуклеарните антитела, открити по метода на непряката имунофлуоресценция или по подобен метод във всеки период на заболяването при липса на прием на лекарства, които причиняват лупус-подобен синдром.
Лечение на лупус
Основата на лечението са хормоните глюкокортикоиди. Най-високите дози се използват при остро протичане, обостряне на заболяването и висока активност. Средната доза е 1-1,5 mg / kg / ден. (по отношение на преднизона).
Първоначалната доза се избира така, че да се намали активността на процеса, решавайки проблема поотделно. С III степен на активност дозата на преднизолон е 60-40 mg, при II - 30-40 mg, с I - 15-20 mg. Ако състоянието на пациента не се е подобрило през първите два дни, дозата се увеличава с 20-30%.
Лечението на лупус с хормони в максималната доза се провежда до постигане на клиничния ефект (4-6 седмици), след това дозата се намалява с не повече от 1/2 таблетка преднизолон седмично. При много високи дози можете да започнете намаляването с по-голяма доза - 5 mg / седмица. От няколко години се използват поддържащи дози от 2,5-5 mg / ден.
Колкото по-ниска е необходимата доза за поддържане на ремисия, толкова по-добра е прогнозата. При продължително хормонално лечение са възможни усложнения: поява на язви на храносмилателния канал, захарен диабет, синдром на Иценко-Кушинг, психични разстройства, метаболитен метаболизъм, остеопороза, активиране на хронична инфекция и др.
С неефективността на хормоните е необходимо назначаването на цитостатични имуносупресори. Често се използват азатиоприн и циклофосфамид в доза 1-2 mg / kg. Метотрексат 15 mg седмично. Микофенолат мофетил 1,5-2 g / ден. Циклоспорин 2,5-4 mg / kg / ден. Курсът на лечение е 6-8 седмици, след това се поддържа поддържаща доза в продължение на много месеци. Подобряването на лечението на цитостатиците настъпва след 4-6 седмици.
При лупус излагането на слънце е противопоказано.
В диетата е необходимо да се наблюдава ниско съдържание на мазнини, високо съдържание на полиненаситени мастни киселини, калций и витамин D.
Пулсовата терапия с метилпреднизолон се провежда според следните показания: бързо прогресиращ гломерулонефрит, млада възраст, висока имунологична активност. Пулсовата терапия не е „терапия на отчаянието“, а неразделна част от програмата за интензивно лечение.
В допълнение към класическата пулсова терапия (метилпреднизолон 15-20 mg / kg телесно тегло IV дневно в продължение на 3 последователни дни), пулсотерапията се предписва отново с интервал от няколко седмици. Пулсовата терапия може да се засили чрез циклофосфамид 1 g интравенозно на 2-ия ден от лечението. След пулсова терапия дозата на преднизон трябва да бъде намалена бавно.
Интравенозният имуноглобулин G е нормален мултиспецифичен имуноглобулинов препарат, получен от серуми от поне 5000 донори. Стандартните лекарства са сандоглобулин, октагам. Имуноглобулинът се предписва като "краен случай" при 0,5 g на 1 kg телесно тегло за следващите 5 дни. При пациенти с лупус нефрит прилагането на имуноглобулин изисква голяма предпазливост поради опасност от рязко прогресиране на бъбречна недостатъчност. Алергичните реакции се проявяват под формата на втрисане, обрив, треска, замаяност и гадене. Абсолютно противопоказание за употребата на интравенозен имуноглобулин е дефицитът на имуноглобулин А.
Плазмафереза. В модерен дизайн плазмаферезата се извършва с помощта на центрофуга или мембранна технология, с отстраняване на 40-60 ml / kg плазма в една процедура. Препоръчителните курсове за плазмафереза \u200b\u200bсе състоят от 3-6 процедури, извършвани последователно или на кратки интервали.
Плазмаферезата при пациенти със системен лупус еритематозус е показана като остра интервенция при сложна криоглобулинемия, хипервискозен синдром и тромбоцитопенична пурпура. Плазмаферезата може да се използва като допълнително високоефективно средство при състояния, пряко застрашаващи живота: фулминантна васкулит, полимиелорадикулоневрит, церебрална кома, хеморагичен пневмонит. Връзката на плазмаферезата при случаи на лупус нефрит, резистентни към хормони и цитотоксични лекарства, е оправдана.
Сред методите за сорбционно лечение се различават селективно и неселективно отстраняване на патологични протеинови структури от кръвообращението. HS е неселективен и се основава на физикохимичните свойства на активен въглен. В допълнение към директното отстраняване на CEC, автоантитела и цитокини, HS стимулира антиидиотипичната активност, фагоцитозата и повишава чувствителността на клетъчните рецептори към лекарствата. При лечението на пациенти със SLE GS има същите показания като PF. Селективната сорбция се провежда с използване на селективни имуносорбенти (биологични или химични), способни целенасочено да отстранят RF, антитела срещу ДНК и СЕС.
Експерименталните проучвания в тази област показват високата ефективност на имуносорбенти при пациенти със SLE с висока имунологична активност. Страничните ефекти от екстракорпоралната терапия обикновено се свеждат до преходна хиповолемия и втрисане, пептична язва в остър стадий, маточно кървене и непоносимост към хепарин са противопоказание.
Въпреки понякога фантастичните резултати в критични ситуации със SLE, PF и HS, като независими методи на лечение, те рядко намират своето място в планираната терапия. Употребата им до голяма степен се ограничава от развитието на така наречения ребаунд синдром, който се появява непосредствено след процедурата и се характеризира с рецидив на клиничната активност и рязко повишаване на нивото на антитела и CEC. Потискането на активността на продуциращи антитела b-лимфоцити и предотвратяването на синдрома на ребаунда се постига чрез последователната, едновременна употреба на PF и PT MP-CF. Синхронизацията на интензивните грижи под формата на многомесечна програма може да надвиши ефективността на всички известни методи за лечение на SLE с неблагоприятна прогноза за живота.
Има няколко метода на синхронна интензивна грижа:
- Поредица от плазмафереза \u200b\u200bот 3-6 последователни процедури с допълнителен кратък курс на мегадози на CF интравенозно;
- Първоначалната серия от процедури на PF (обикновено 3) едновременно с венозното приложение на 1 g CF и 3 g MP и впоследствие една PF процедура за 1-3 месеца. през годината, синхронно с 1 g TF и \u200b\u200b1 g MP.
Втората схема на синхронната интензивна грижа е по-убедителна, тъй като осигурява контрол на програмата за една година. Програмираната цел на комбинацията от PF и PT MP и CF е показана предимно за пациенти със SLE с неблагоприятна жизнена прогноза поради появата на системен лупус еритематозус в юношеска и млада възраст, бързото развитие на нефротичен синдром, бързо прогресиращия тип нефрит, персистиращата артериална хипертония и развитието на животозастрашаващи състояния ( церебрална криза, напречен миелит, хеморагичен пневмонит, тромбоцитопения и др.).
През последните години агресивните методи на лечение престават да бъдат „терапия на отчаянието“, съдбата на отделенията за интензивно лечение и спешните ситуации. Планираното назначаване на тези методи може значително да подобри дългосрочната прогноза за живота при значителна част от пациентите със СЛЕ. В краткосрочен план появата на нови схеми и програми за интензивно лечение на SLE, например, синхронизация на TIG и PF, имуносорбция и CF, шокови дози на интерферонови препарати и антититокинови антитела.
За лечение на тежка SLE е предложена автоложна трансплантация на стволови клетки.
Прогнозата за продължителност на живота е значително намалена при наличие на антифосфолипиден синдром.
Системен лупус еритематозусСистемен лупус еритематозус(SLE) е автоимунно ревматично заболяване, което се основава на имунорегулаторни дефекти, водещи до неконтролирано свръхпроизводство на антиядрени автоантитела към компонентите на ядрата и цитоплазма на клетките на собствените им тъкани и развитие на хронично възпаление, което засяга много органи и системи.
SLE е хронично полисиндромно заболяване главно на млади жени и момичета.
Според ICD-10 - M32 системен лупус еритематозус.
Болестта получи името си поради характерната си особеност - обрив по моста на носа и бузите (засегнатата област наподобява пеперуда по форма), за която се смяташе, че през Средновековието прилича на ухапвания от вълк.
Епидемиология. Няма точна информация за разпространението на SLE у нас. В САЩ това е 48 случая на 100 000 жители.
Етиология. Конкретен етиологичен фактор при SLE не е установен. Най-призната е ролята на вирусна инфекция.
Причини: в кръвта на пациентите е установено увеличение на AT титрите за редица вируси, съдържащи РНК (морбили, рубеола, параинфлуенца и др.), Както и за херпетични вируси, съдържащи ДНК, като EBV, вирус на херпес симплекс; вирусоподобни включвания се намират в ендотела на тъканите на засегнатите органи.
Установено е семейно предразположение към SLE, съгласуваност в честотата на SLE при 50% от хомозиготни близнаци и наличието на антиядрени AT са открити при 2/3 от близнаците.
При SLE, HLA A11, B7 антигените са по-често срещани, отколкото при контролите, има увеличение на съдържанието на HLA антигени от DR2 и DR3 групите и те са свързани с функцията на имунния отговор.
През последните години се откриват все повече доказателства за генетичната природа на SLE.
Така изследователи от Колорадо откриха гена Ifi202, който е отговорен за развитието на SLE, други гени също дават по-слаб принос за развитието на това заболяване.
Например, някои варианти на маноза-свързващия лектинов ген, суроватъчен протеин, участващ в имунния отговор на организма, повишават риска от артериална тромбоза (и по-специално инфаркт на миокарда) при пациенти със SLE.
Патогенеза. SLE е имунокомплексна болест, характеризираща се с неконтролирано производство на AT. Централната връзка е загубата на толерантност към автоантигени. AutoAT участват във формирането на ИК, които от своя страна определят появата и развитието на различни признаци на заболяването, особено увреждане на бъбреците и централната нервна система. Циркулацията на множество АТ е свързана с хиперреактивността на В клетки, произвеждащи тези АТ.
В кръвта и костния мозък броят на клетките, отделящи различни Ig, се увеличава. Неконтролираното производство на AT възниква както поради спонтанната В-клетъчна хиперреактивност, така и поради хиперфункцията на Т-хелпери (C04 лимфоцити) на фона на дисфункцията на CDS лимфоцитите.
При SLE значително количество антитъканни АТ, както и IR, имат антиорганични детерминанти за различни органи. По-специално бяха открити анти-сърдечни, анти-кардиолипидни, анти-бъбречни и други AT, както и AT, насочени срещу отделни елементи на кръвта, т.е. анти-левкоцити, анти-тромбоцити и анти-еритроцити.
Клиничната картина. Предимно болни жени в млада възраст. Заболяването може да се развие остро (при 1/3 от пациентите), но често започва постепенно.
Клиничната картина се характеризира с полиморфизъм на симптомите и прогресията.
На първо място по честота е поражението на ставите.
Засягат се предимно малки стави на ръцете и глезенните стави.
Ставният синдром може да се прояви като артралгия и полиартрит. Последният обикновено протича без деформация.
Кожни лезии.
Най-типичният симптом е обрив във формата на пеперуда, който заема носа, крилата на носа и областта на назолабиалната гънка.
По цялото тяло могат да се появят еритематозни обриви.
Следващият най-често срещан симптом е разнообразна треска. Най-важният клиничен признак на SLE е полисерозитът, най-често плеврит, но може да има и перикардит.
Лимфаденопатия. Доста често има увеличение на лимфните възли. Те са меки, без възпалителни промени.
Висцерални лезии. CCC се повлиява под формата на фокален или дифузен миокардит - специален вид ендокардит без изразена клетъчна реакция (ендокардит на Либман-Сакс).
В белите дробове може да се развие вид лупус пневмонит, много рядко - фиброзиращ алвеолит (синдром на Hammen-Rich).
Една от най-тежките лезии при SLE е лупусната нефропатия (лупус нефрит), която може да се прояви в различни форми - от промени, които се откриват само с електронна микроскопия, до картината на мембранозна нефропатия.
Лупусният хепатит е рядък, в около 1/4 от случаите се открива спленомегалия.
Прогностично най-тежката проява на SLE е лупусният нефрит, който е имунокомплексна гломерулна болест с много сложна патогенеза, т.е.
Той се основава на Т-клетъчен имунитет, автоимунен отговор на автоантигени.
В този случай ДНК или нуклеозоми действат като автоантигени. Образуването на отделни автоантитела, стимулирани от последните с различна реактивност по отношение на гломерулните антигени, води до различни наранявания, което определя отделните разновидности на заболяването. Автоантителата, образувани от В клетки, предизвикват активиране на автореактивни Т клетки, които инфилтрират бъбреците и причиняват васкулит и интерстициален нефрит.
Има 6 класа, съответстващи на определени фази на заболяването:
клас I - морфологично, бъбреците са непокътнати;
клас II - пролиферация на мезангиални клетки;
iII клас - фокална пролиферация или фокална некроза;
клас IV - дифузна пролиферация с (или без) фокална некроза;
клас V е мембранният вариант, а клас VI е крайният етап.
Диагноза. Лабораторни изследвания: приблизително половината от пациентите имат хипо- или нормохромна анемия и левкопения, специални изследвания могат да открият LE клетки (неутрофили, в цитоплазмата на които има кръгли или овални включвания, състоящи се от деполимеризирана ДНК).
Промените в ESR и протеиновите фракции са много значителни.
Особено значително увеличение на b-глобулините.
Диагностични критерии Американска ревматологична асоциация (1982):
1) обриви в зигоматичната област ("пеперуда");
2) дискоиден обрив (еритемни плаки с кератоза);
3) фоточувствителност; кожни обриви в резултат на необичайна реакция на излагане на слънце;
4) перорални язви;
5) артрит на две или повече периферни стави;
6) серозит (плеврит, перикардит);
7) увреждане на бъбреците с персистираща протеинурия от 0,5 g / ден или повече;
8) неврологични разстройства - конвулсии;
9) хематологични нарушения - хемолитична анемия, левкопения (по-малко от 4 x 10 * 9 / l), лимфопения (по-малко от 1,5 x 10 * 9 / l), тромбоцитопения (по-малко от 100 x 10 * 9 / l), регистрирана най-малко 2 време;
10) имунни нарушения - положителен LE тест, AT за ДНК и нативна ДНК, фалшиво положителна реакция за сифилис (RIP и RIF) за 6 месеца;
11) увеличаване на съдържанието на антиядрен AT, който не е свързан с лекарства, които могат да причинят SLE.
Смята се, че ако има 4 или повече признака, диагнозата на SLE е надеждна.
През последните години имунологичните изследвания, по-специално определянето на титъра на антиядрен фактор (ANF - антитела към вътреядрени структури), придават голямо значение при диагностицирането на SLE. ANF \u200b\u200bсе открива чрез индиректна имунофлуоресценция.
Както видът на антителата, така и естеството на сиянието в имунофлуоресцентната материя.
Опции за ANF:
- AT за двуверижна ДНК (корелира с активността на SLE и развитието на лупус нефрит, дава хомогенен и периферен блясък);
- AT към хистони (хомогенно сияние);
- AT към малки ядрени рибонуклеопротеини (заскребена луминесценция).
От инструменталните методи за диагностика трябва да се отбележи биопсия на бъбреците, която позволява да се определи наличието и вида на лупус нефрит, рентгенография - когато е включена в патологичния процес на белите дробове и ехокардиографията - за идентифициране на естеството на сърдечно увреждане.
CT и NMR помагат да се диагностицира степента на участие в централната нервна система.
Класификация. SLE се класифицира по клиничен курс.
Остър курс: остро начало в следващите 3-6 месеца, изразен полисиндромизъм - лупус нефрит или увреждане на централната нервна система.
Субакутен ход: заболяването започва постепенно с общи симптоми, артралгия, различни, обикновено неспецифични кожни лезии.
В рамките на 2-3 години се развива характерен полисиндромизъм.
Хроничен ход: болестта дълго време се проявява в рецидиви на определени синдроми - полиартрит, по-рядко полисерозит, синдром на лупус еритематозус, синдром на Рейно.
На 5-10-та година се присъединяват други лезии на органи (нефрит, пневмонит); на 10-15-та година могат да се развият явленията на деформиращ полиартрит.
Според клинични и лабораторни данни те се разграничават три степени на активност:
1-ва степен на дейност: нормална телесна температура, лека загуба на тегло, дискоидни огнища на кожни лезии, адхезивен плеврит и перикардит, кардиосклероза; увреждането на бъбреците е ограничено до синдром на урината, Hb 120 или повече g / l, γ-глобулини в рамките на 20-23%, LE клетки - единични (на 1000 левкоцити) или липсващи, ANF титър 32 и хомогенен тип флуоресценция AT по време на имунофлуоресценция;
2-ра степен на дейност: телесната температура е повишена, но< 38С умеренное похудание, поражения кожи в виде эритемы, сухой плеврит и перикардит, умеренный миокардит, поражение почек проявляется нефритическим синдромом, НЬ 100-110 г/л, у-глобулины 24-30%, LE-клетки - 1-4 на 1000 лейкоцитов, титр АНФ - 64, тип свечения AT при иммунофлуоресценции гомогенный или периферический;
3-та степен на дейност: повишена телесна температура -\u003e 38 ° C изразена загуба на тегло, кожни лезии под формата на "пеперуда", капиларит, излив плеврит и перикардит, тежък миокардит, нефротичен синдром, Hb< 100г/л, у-глобулины 30-35%, LE-клетки - 5 и > на 1000 левкоцити, титър ANF - 128, периферен тип луминесценция AT по време на имунофлуоресценция. От лабораторните критерии тежестта на левкопенията корелира с активността на процеса в по-голяма степен и увеличаването на СУЕ, хипохромната анемия и тромбоцитопенията в по-малка степен.
Приблизителна формулировка на диагнозата.
Системен лупус еритематозус, подостър курс, с кожни лезии (еритема под формата на "пеперуда"), стави, бели дробове (десностранна ексудативна плеврит), сърце (перикардит), бъбреци (мезангиално-капилярен гломерулонефрит), активност II степен, NK 1-ва, CRF. 1 супена лъжица.
Лечение.За контрол на болестта в момента се използва почти целият арсенал от противовъзпалителни и цитотоксични лекарства, чието използване значително подобри прогнозата за живота на пациентите.
Ако преди 1970г продължителността на живота само на 40% от пациентите със SLE надвишава 5 години, тогава в момента 5-годишната преживяемост е 90% или повече.
В тази връзка е трудно да се надцени значението на глюкокортикостероидите (GCS), ефектът от които се проявява почти веднага след назначаването.
GCS бяха и остават лекарствата на избор в острия ход на заболяването с висцерални прояви.
Нов етап в употребата на GCS при SLE беше въвеждането на венозна инжекция на ултрависоки дози - пулсова терапия, която се оказа много ефективна при неизлечими преди това пациенти.
Наличните данни показват значителен имуносупресивен ефект от интравенозно приложение на високи дози кортикостероиди през първия ден.
Шоковите дози кортикостероиди (предимно метилпреднизолон) спират образуването на имунни комплекси, отлагат се в възпалени тъкани в по-голяма степен и блокират вредния ефект на лимфотоксините.
Беше идентифицирана определена категория пациенти (млада възраст, бързо прогресиращ лупус нефрит, висока имунологична активност, тежък цереброваскуларит, системен васкулит), при който този метод трябва да се използва в началото на заболяването или незабавно - с всяко обостряне.
Схема на лечение: дневно iv в продължение на три последователни дни, метилпреднизолон се прилага със скорост 15-20 mg на kg тегло на пациента в 100 ml изотоничен разтвор на натриев хлорид едновременно или 500 mg в две разделени дози.
Хепарин (5000 U) и супрастин се добавят към инфузираната течност.
За да се увеличи ефективността, се предписват шокови дози метилпреднизолон на интервали от няколко седмици в продължение на няколко месеца.
За да се засили въздействието върху имунопатологичните процеси, програмираното назначаване на пулсова терапия с метилпреднизолон може да бъде подобрено чрез добавяне на циклофосфамид (iv за 5-10 дни).
В случаи на резистентност към тези лекарства, както и при наличието на няколко прогностично неблагоприятни фактори, обещаваща е синхронна интензивна терапия, основана на комбинация от пулсотерапия и екстракорпорални методи на лечение (плазмафереза).
Ако не е възможно да се постигне стабилна ремисия, тогава е необходимо да се предпишат други средства - цитостатични имуносупресори, които се използват в комбинация със средни дози преднизолон.
Показания за назначаване на цитостатици: висока активност и бързо прогресиращ курс; активни нефротични и нефритни синдроми; недостатъчно лечение на кортикостероиди; необходимостта от бързо намаляване на огромната доза преднизолон; необходимостта от намаляване на поддържащата доза на преднизон, ако надвишава 15-20 mg; кортикостероидна зависимост.
Най-често използвани са азатиаприн (имуран) и циклофосфамид в доза 100-200 mg / ден (1-3 mg / kg телесно тегло), за предпочитане в комбинация с 30 mg преднизолон. Курсът на лечение е 2-2,5 месеца.
След това преминават към поддържаща доза, която обикновено е 50-100 mg / ден и се предписва в продължение на много месеци.
Възможни усложнения: левкопения, тромбоцитопения, агранулоцитоза, диспептични симптоми, инфекциозни усложнения, хеморагичен цистит. Възможно е да се предписват аминохинолинови препарати в комбинация с GCS - делагил, плакенил (0,25 g 1-2 пъти на ден), особено при наличие на кожни лезии.
В случай на системно уголемяване на лимфните възли се предлага тяхното облъчване.
НСПВС се предписват в терапевтични дози при лечение на треска, ставен синдром и серозит.
През последните години циклоспорин А предизвиква голям интерес, който се счита за едно от най-ефективните лекарства със селективна имуносупресивна активност.
Все по-често се използва в клиничната практика за лечение на много имуно-възпалителни заболявания на вътрешните органи, включително SLE. Специфичните механизми, които определят ефективността на циклоспорин А (CsA) при SLE, не са напълно разбрани.
Очевидно е, че по естеството на ефекта върху синтеза на цитокини CSA е много близък до GCS.
Не може да се изключи, че един от важните механизми на действие на CSA при SLE е свързан с инхибиране на синтеза на интерферон-u.
Интерес представлява способността на CSA да инхибира експресията на CD40 лиганда върху мембраната на Т-лимфоцитите.
Високи дози CSA: 10 mg / kg / ден в продължение на 7 седмици.
Лечението на CSA влияе положително върху активността на заболяването, засяга тежката патология на органите, а използването на ниски дози и внимателното наблюдение на терапията може да избегне развитието на тежки странични ефекти.
CSA може да се счита за алтернативно лекарство от втора линия за непоносимост и неефективност на кортикостероидите и цитостатиците.
В допълнение, безспорните положителни аспекти на включването на CSA в схемата на лечение на SLE трябва да се считат за по-ниска честота на съпътстваща инфекция и възможността за предписване по време на бременност.
Окуражаващи резултати бяха получени и с използването на още един селективен имуносупресор, микофенолатен мофетил, при пациенти със SLE.
Mofetil mycophenolate (Sellcept) е синтетичен морфолиноетил естер на микофенолова киселина и е негов предшественик.
След като приемат микофенолат мофетил вътре, чернодробните естерази го превръщат напълно в активно съединение - микофенолова киселина, която е неконкурентен инхибитор на инозин монофосфат дехидрогеназа, ензим, който ограничава скоростта на синтеза на нуклеотиди на гуанозин.
Терапията на микофенолат мофетил в дози от 1,5-2 g / ден води до намаляване на протеинурията, стабилизиране на серумния креатинин, нормализиране на нивата на С3 компонента на комплемента и антитела към ДНК и намаляване на активността на SLE.
През последните години използването на някои имуномодулатори, като талидомид, биндарит, нуклеозидни аналози (флударабин 25-30 mg / m, I / O за 30 минути, мизорибин, лефлуномид), се превърна в друга област на терапия за SLE.
Използването на тези лекарства в експериментални модели на лупус-подобна болест доведе до намаляване на протеинурията и увеличаване на оцеляването на мишката.
В момента е натрупан известен опит с употребата на тези лекарства при пациенти със SLE.
Клиничните изпитвания на талидомид се провеждат главно при пациенти с тежки кожни лезии, резистентни на антималарийни лекарства и GCS.
По-голямата част от пациентите успяха да постигнат добър ефект и да намалят дозата на кортикостероидите, докато изтеглянето на лекарството не доведе до изостряне на симптомите.
Основното ограничение при използване на талидомид е неговата тератогенност.
Освен това е описано развитието на необратима периферна невропатия в зависимост от дозата и продължителността на лечението.
Перспективите за лечение на пациенти със SLE несъмнено стоят зад биологичните методи на експозиция, използвайки така наречените „биологични“ средства. Тези лекарства са разработени с цел да повлияят на специфични имунологични процеси, които включват активиране на Т-клетките, взаимодействие с Т-В клетките, АТ продукция на двуверижна ДНК, активиране на цитокини и други.
В тази връзка, използването на анти-идиотипичен моноклонален AT, iv имуноглобулин представлява големи възможности.
Има малко данни за ефективността в експериментални лупус модели на рекомбинантна ДНКаза, ДНК-разцепващ ензим.
В момента най-агресивното лечение на SLE е автоложна трансплантация на стволови клетки (ATSC).
Предварителните положителни резултати, разбира се, се нуждаят от допълнително потвърждение.
Необходимо е дългосрочно наблюдение на пациентите, като се има предвид възможността за индуциране на фона на лечението за развитие на злокачествени тумори.
Въпреки впечатлението, че този вид терапия е ефективна в случаи на рефрактерно и тежко протичане на SLE, ATSC може да се препоръча само в най-тежките, безнадеждни случаи поради високата му смъртност.
През последните години беше въведен нов метод - имуносупресивна терапия с високи дози с трансплантация на периферни хематопоетични стволови клетки.
Важна област на фармакотерапията за SLE е да се предотврати развитието или лечението на съпътстваща (често лекарство) патология, предимно ранна атеросклероза, остеопороза, инфекциозни усложнения, които имат не по-малко отрицателно въздействие върху прогнозата за живота, отколкото самата болест.
Това определя необходимостта от по-широко въвеждане на съвременни антихипертензивни, липидопонижаващи, антиостеопоротични и антимикробни лекарства. Тъй като някои от тях, като статини, антибиотици и евентуално бисфосфонати, имат противовъзпалително и имуномодулиращо действие, използването им може потенциално да повиши ефективността на лечението на възпалителни ревматични заболявания.
Профилактиката се състои предимно в предотвратяване на обостряния. Основното нещо е дългосрочен прием на поддържащи дози на GCS, елиминиране на вредното въздействие на външната среда (инсолация), навременно лечение на интеркурентни заболявания.
перспектива остава сериозен, особено с увреждане на бъбреците.
С навременното разпознаване и правилното лечение повечето пациенти успяват да постигнат дългосрочна ремисия.