Епигеном: паралелна реалност в клетката. Епигенетика: какво движи генетичния ни код? Развития и планове за бъдещето
наука
Какво ще стане, ако решението ви днес да изядете още един пакет чипс или да изпушите друга цигара може да повлияе не само на вашето здраве, но и на здравето на децата ви? Освен това, какво, ако начинът ви на живот се отразява на здравето на вашите деца, внуци и правнуци? Както се оказа, много повече, отколкото си представяхме, зависи от ежедневния ни избор.
Традиционният възглед на ДНК е, че тя се изразява чрез нашите гени, които ни помагат да оцелеем, да се размножаваме, да се развиваме, а също и че ДНК е постоянна ценност, която е засадена от природата в продължение на хилядолетия. Сега обаче изглежда, че условията на околната среда, като стрес, хранене и околната среда, влияят върху това как се държи не само нашата ДНК, но и ДНК на нашите деца, дори и те да са само в проекта.
Всичко това се отнася до сравнително нова наука, наречена епигенетика. По-долу разглеждаме петте най-значими открития на епигенетиката, както и какво означават те за нашето здраве.
5. Какво може да направи ДНК е по-важно от структурата му.
 ДНК е важна структура, обаче, тя не е отговорна за всичко. Подобни надзорни функции принадлежат към епигенома. Както описа Джон Облак, епигеномът поема юздите в горната част на генома и казва на всеки ген да работи или не чрез епигенетични маркери. Това е в основата на епигенетиката, изследването на промените в поведението на нашите гени, които могат да бъдат предадени, без всъщност да се промени генетичният ни код. Потенциално това означава, че тялото ни може да има биологични реакции към условията на околната среда, които влияят положително или отрицателно върху здравето ни, без да променят ДНК.
ДНК е важна структура, обаче, тя не е отговорна за всичко. Подобни надзорни функции принадлежат към епигенома. Както описа Джон Облак, епигеномът поема юздите в горната част на генома и казва на всеки ген да работи или не чрез епигенетични маркери. Това е в основата на епигенетиката, изследването на промените в поведението на нашите гени, които могат да бъдат предадени, без всъщност да се промени генетичният ни код. Потенциално това означава, че тялото ни може да има биологични реакции към условията на околната среда, които влияят положително или отрицателно върху здравето ни, без да променят ДНК.
Например, Cloud предлага да се илюстрира епигенетиката, като се погледнат близнаци, които притежават идентичен генетичен материал. Защо тогава близнаците не страдат от едни и същи заболявания, като например астма или психични разстройства? Играе ли роля в този случай епигенетиката? В момента именно тези въпроси са заети от науката. В допълнение, изследователите проучват дали има лекарства или методи, които могат да бъдат използвани за подобряване на генетичното поведение към по-добро.
4. Когато става дума за развитие на заболяване, епигенетиката задава тона.
 Добре е ДНК да се използва като изкупителна жертва, но има и други фактори, които увеличават шансовете ни за развитие на конкретна болест, включително: проблеми в околната среда, неправилно хранене, социални взаимодействия и влияния на околната среда, които допринасят за епигенетичните промени.
Добре е ДНК да се използва като изкупителна жертва, но има и други фактори, които увеличават шансовете ни за развитие на конкретна болест, включително: проблеми в околната среда, неправилно хранене, социални взаимодействия и влияния на околната среда, които допринасят за епигенетичните промени.
Както отбелязва Сара Балдауф, специалист по епигенетика, изразяването на епигенетични промени в по-късна възраст може да причини свързани с възрастта заболявания, като например болестта на Алцхаймер. "С възрастта нашите гени също остаряват, така че те могат просто да се изключат, което води до болестта", казва тя. Какво означава това? Изследователите се надяват да разработят лекарства, които ще контролират епигенетичните промени и това ще ни защити или спре болестта.
Освен това тя предоставя един пример за работата на изследователски екип, който открива епигенетични промени при мишки, довели до развитието на лупус при гризачи. Те обаче успяха да излекуват напълно мишките, като създадоха лекарство, което предизвика епигенетични промени.
3. Епигенетиката е тясно свързана с развитието на рак
 Преди това раковите заболявания вече са включени в списъка на потенциалните заболявания, свързани с епигенетични промени. Тази тема заслужава по-нататъшно обсъждане поради вероятността от тясната й връзка с науката.
Преди това раковите заболявания вече са включени в списъка на потенциалните заболявания, свързани с епигенетични промени. Тази тема заслужава по-нататъшно обсъждане поради вероятността от тясната й връзка с науката.
Изследователите обмислят възможността промените в епигенома да причинят растеж на тумор. Преди време експертите смятат, че ракът е свързан или с мутации, поради които клетките ни спират да ни защитават, или със загубата на тази защита по време на клетъчното делене. Това обаче е вярно и има трета причина. Туморите могат да растат, защото добрите клетки с отлична защита получават епигенетичен сигнал да не си вършат работата. С помощта на лекарства и дори да променим начина на живот, в бъдеще може да успеем да променим епигенетичното поведение и да върнем тези защитни клетки да работят.
Неотдавнашна конференция на Американския институт за изследване на рака разгледа връзката между епигенетиката и рака. Например, един от специалистите Родерик Дашвуд описа проучване, което показа, че с помощта на определени храни, като броколи, е възможно да се „изключи“ работата на специални протеини, които се развиват в човешкото тяло заедно с рака и не позволяват на клетките да умират по естествен начин.
2. Пренаталната грижа е необходима, за да се наблюдават епигенетичните промени.
 Какво се случва, ако бременният плъх е изложен на инсектициди и фунгициди? Ще се отрази ли на нейното потомство? Разбира се, да. По време на изследването по време на такова излагане са настъпили епигенетични промени, които водят до увеличаване на случаите на мъжко безплодие или допринасят за много слабо производство на сперма. Нещо повече, тези епигенетични промени продължават през следващите четири (!) Поколения. Следователно, пренаталната грижа е ключът към здравето на нашите потомци и бъдещите поколения.
Какво се случва, ако бременният плъх е изложен на инсектициди и фунгициди? Ще се отрази ли на нейното потомство? Разбира се, да. По време на изследването по време на такова излагане са настъпили епигенетични промени, които водят до увеличаване на случаите на мъжко безплодие или допринасят за много слабо производство на сперма. Нещо повече, тези епигенетични промени продължават през следващите четири (!) Поколения. Следователно, пренаталната грижа е ключът към здравето на нашите потомци и бъдещите поколения.
По този начин, ако пренаталната грижа е важна, има ли определен период на бременност, през който е необходим специален контрол? Изглежда така. Изследване, проведено от Колумбийския университет, свързва неадекватното хранене по време на бременност с отрицателни последствия за здравето на бебето през целия му живот. Още по-интригуващ обаче беше фактът, че недохранването е особено опасно през първите 10 седмици от бременността.
1. Епигенетиката се свързва не само с екологията, но и със социалните взаимодействия.
 Що се отнася до епигенетиката, броенето колко пъти на ден прегръщате детето си придобива съвсем различно значение. Епигенетичните промени също се свързват със социални и поведенчески взаимодействия.
Що се отнася до епигенетиката, броенето колко пъти на ден прегръщате детето си придобива съвсем различно значение. Епигенетичните промени също се свързват със социални и поведенчески взаимодействия.
Едно от проучванията показа, че поведението на бебетата в бъдеще и техните епигенетични маркери зависят от това как плъхът се грижи за своите малчугани. Освен това екип от изследователи показа, че те могат да компенсират липсата на грижи с помощта на специални лекарства, като по този начин променят епигенетичния фон.
Що се отнася до хората, когато в живота им се случват стресови ситуации, те също оставят своя отпечатък върху това как се държи геномът ни. В допълнение, епигенетичните промени се запазват дори и след като хормонът на стреса напусне тялото ни.
Генетиката предполага, а епигенетиката разполага.Генетиката предполага, а епигенетиката разполага. Защо бременните жени трябва да приемат фолиева киселина?
Винаги ме впечатляваше един интересен факт - защо някои хора се опитват толкова силно да водят здравословен начин на живот, да не пушат, да спят за предписания брой часове всеки ден, да ядат най-свежите и естествени храни, с една дума, да правят всичко, което е толкова назидателно Лекарите и диетолозите казват, че понякога живеят много по-малко от тежките пушачи или предпочитат да не се ограничават много до храна на легло? Може би лекарите просто сгъстяват цветовете си?
Какво става?
Работата е там, че клетките на нашето тяло имат памет и това е напълно доказан факт.
Нашите клетки съдържат в ядрата си един и същ набор от гени - ДНК секции, които носят информация за протеинова или РНК молекула, които определят пътя на развитието на организма като цяло. Въпреки факта, че молекулата на ДНК е най-дългата молекула в човешкото тяло, която съдържа пълна генетична информация за индивида, не всички ДНК секции работят еднакво ефективно. Във всяка конкретна клетка могат да работят различни участъци от макромолекулата и повечето от човешките гени са напълно неактивни. Човешките ДНК гени, кодиращи протеин, представляват по-малко от 2% от генома и те се считат за носители на всички генетични черти. Тези гени, които носят основна информация за структурата на клетката, са просто активни през целия живот на клетката, но редица други гени „работят“ непоследователно и работата им зависи от много фактори и параметри, включително външни.
Има доста голям брой наследствени заболявания, сред които особено се отличават генните заболявания - така наречените моногенни заболявания, които възникват при увреждане на ДНК на генно ниво - това са многобройни метаболитни заболявания на въглехидрати, липиди, стероиди, пурини и пиримидини, билирубин, метали, съединителна тъкан и т.н. нататък. Известно е, че предразположението към определено заболяване често се наследява, следователно човек може да бъде само носител на мутации в структурни гени и да не страда от генетично заболяване.
Паметник в близост до Института по цитология и генетика SB RAS, Akademgorodok, Новосибирск
В човешкото тяло има специални механизми за контрол на генната експресия и клетъчната диференциация, които не влияят върху самата структура на ДНК. „Контролери“ могат да бъдат разположени в генома или да представляват специални системи в клетките и да упражняват контрол върху работата на гените в зависимост от външни и вътрешни сигнали от различно естество. Подобни процеси са дело на епигенетиката, която оставя своя отпечатък дори върху излишната генетика и последната може в крайна сметка да не бъде реализирана. С други думи, епигенетиката предоставя обяснение как факторите на околната среда могат да повлияят на генотипа чрез „активиране“ или „дезактивиране“ на различни гени. Питър Медауар, Нобелов лауреат по биология и медицина, чийто капацитетен израз е поставен в заглавието на статията, много точно формулира значението на влиянието на епигенетиката върху крайния резултат.
Какво е това и с какво се храни?
Епигенетиката е много млада наука: съществуването й не наброява дори сто години, което обаче не й пречи да бъде в статута на една от най-обещаващите дисциплини на последното десетилетие. Тази тенденция е толкова популярна, че напоследък бележки за епигенетичните изследвания често се появяват в сериозни научни списания, както и в месечни книги за широк кръг читатели.
Самият термин се появява през 1942 г. и е измислен от един от най-известните биолози от мъгливия албион - Конрад Уодингтън. И този човек е известен преди всичко с това, че е поставил основите на интердисциплинарно направление, наречено през 1993 г. термина "системна биология" и обединяване на биологията и теорията на сложните системи.

Конрад Хал Уадингтън (1905-1975)
В книгата на германския невробиолог Питър Спорк, "Четене между струните на ДНК", произходът на този термин се обяснява по следния начин - Уодингтън предложи име, което е нещо между самия термин "генетика" и "епигенеза", дошъл при нас от произведенията на Аристотел - така че кога Това се нарича учението за последователното ембрионално развитие на тялото, по време на което се образува нови органи. Преведено от гръцки " епи„Означава“ върху, отгоре, отгоре, „епинетика - това е нещо като„ над “генетика.
Първоначално епигенетиката беше много пренебрегвана, което, разбира се, беше резултат от неясни идеи за това как могат да се реализират различни епигенетични сигнали в тялото и до какви последствия могат да доведат. По времето на публикуването на произведенията на Конрад Уодингтън разпръснати спекулации бяха в научния свят, а основата на самата теория все още не беше изградена.
Скоро стана ясно, че един от епигенетичните сигнали в клетката е метилиране на ДНК, тоест добавяне на метилова група (-CH3) към цитозиновата основа в ДНК матрицата. Оказа се, че подобна модификация на ДНК води до намаляване на генната активност, тъй като този процес може да повлияе на нивото на транскрипция. От този момент нататък епигенетиката премина през прераждането и накрая се превърна в пълноправен клон на науката.
През 80-те години на миналия век е публикувана работа, в която е показано, че метилирането на ДНК корелира с репресията - „мълчанието“ - на гените. Това явление може да се наблюдава при всички еукариоти, с изключение на дрождите. По-късно нашите сънародници откриха тъканната и възрастовата специфичност на метилирането на ДНК в еукариотните организми и беше показано също, че ензимната модификация на генома може да регулира генната експресия и диференцирането на клетките. Малко по-късно беше доказано, че метилирането на ДНК може да се контролира хормонално.
Професор Моше Зиф (от Университета Макгил, Канада) дава такова образно сравнение: „Нека представим гени в ДНК като изречения, съставени от нуклеотидни букви, получени от родители. Тогава метилирането е като пунктуация, което може да повлияе на значението на фразите, акцентиращите фрази, разбиването на параграфи. В резултат на това целият „текст“ може да се чете по различни начини в различни органи - сърцето, мозъка и т.н. И както сега знаем, подреждането на такива „препинателни знаци“ зависи и от сигналите, които получаваме отвън. Очевидно този механизъм помага да се адаптира по-гъвкаво към променящите се обстоятелства на външния свят. "
В допълнение към метилирането на ДНК има редица епигенетични сигнали от различно естество - деметилиране на ДНК, хистонов код (хистонна модификация - ацетилиране, метилиране, фосфорилиране и други), позициониране на хроматинови елементи, транскрипция и транслационна репресия на гените от малки РНК. Интересното е, че някои от тези процеси са взаимосвързани и дори взаимозависими - това помага за надеждното осъществяване на епигенетичен контрол върху селективното функциониране на гените.
Нека се опитаме да разберем основите
Според Уодингтън епигенетиката е „клон на биологията, който изучава причинно-следствените взаимодействия между гените и техните продукти, съставляващи фенотипа“. Според съвременните концепции многоклетъчният фенотип е резултат от взаимодействието на огромен брой генни продукти в онтогенезата. По този начин генотипът на развиващ се организъм всъщност е епигенотип. Работата на епигенотипа е доста строго координирана и задава определена посока в развитието. Въпреки това, в допълнение към това направление, което в крайна сметка води до реализирането на основната за популацията фенотипова линия (нормен фенотип), съществуват и „пътеки“ - субтреектории, благодарение на които се реализират стабилни, но различни състояния на фенотип. Така се реализира поливариантността на онтогенезата.
Интересно е да се мисли, че първоначално всички клетки на развиващ се индивид са тотипотентни - това означава, че имат еднакъв потенциал за развитие и са в състояние да пораждат всякакъв вид телесни клетки. С течение на времето възниква диференциация, през която клетките придобиват различни свойства и функции, превръщайки се в неврони, червени кръвни клетки, миоцити и т.н. Разминаването на свойствата възниква поради експресията на различни модели на гени: на определени етапи на развитие клетката получава специални сигнали, например, от хормонален характер, които реализират един или друг епигенетичен "маршрут", което води до диференциране на клетките.
Конрад Уодингтън въведе успешна метафора - „епигенетичен пейзаж“, благодарение на която става ясен механизмът на влияние на факторите на околната среда върху развитието на млад еукариотен организъм. Процесът на онтогенезата е поле от възможности, което представлява поредица от епигенетични траектории, по които се прокарва пътят в развитието на индивид от състояние на зигота към възрастен. Всяка „обикновена“ на този пейзаж съществува с причина - тя води до образуването на тъкан или орган, а понякога и на цяла система или част от организъм. Траекториите, които имат предимство, се наричат \u200b\u200bкриволичи в работата на Уодингтън, а хълмовете и хребетите, разделящи траекториите, се наричат \u200b\u200bотблъсквачи от отблъсквачи. През четиридесетте години на миналия век учените нямали представа за физическия модел на генома, така че предположенията на Уодингтън били истинска революция.

Епигенетичен пейзаж от Уодингтън
Развиващият се организъм е топка, която може да се търкаля, следвайки различни „вариации“ на своето развитие. Пейзажът налага някои ограничения върху траекторията на топката, докато се спуска от хълма. Фактор от външната среда може да повлияе на промяната в хода на топката, като по този начин топката пада в по-дълбока кухина, от която не е толкова лесно да се измъкне.
Пропуските между епигенетичните депресии са критични точки за младия организъм, в които процесът на развитие придобива различни форми, включително в зависимост от факторите на околната среда. Преходите между свързващите корита показват процес на развитие между основните промени, а склоновете на коритата характеризират скоростта на този процес: нежните корита са знак за сравнително стабилни състояния, докато стръмните склонове са сигнал за бързи промени. В същото време външните фактори причиняват по-сериозни последици в преходните точки, докато в други области на ландшафта влиянието им може да е незначително. Красотата на идеята за епигенетичен пейзаж се състои в това, че тя добре илюстрира един от принципите на развитие: един и същ резултат може да се постигне по съвсем различни начини.

Критични точки на епигенетичния пейзаж, аналогия с топка: 2 възможни траектории
След изграждането на епигенетичната траектория клетките вече не могат свободно да се отдалечават от пътя си на развитие - така от зигота, единна „начална” клетка се образува еукариотен организъм, който има набор от клетки, които са напълно различни по вид и функция. По този начин, епигенетичното наследяване е наследяването на модел на генна експресия.

Илюстрация към теорията за епигенетичния пейзаж. Опции за развитие на събития
В допълнение към описанието на морфогенезата на конкретен индивид е напълно възможно да се говори за епигенетичния пейзаж на популацията, тоест за предсказуемостта на реализирания фенотип за определена популация, включително относителната честота на възможните променливи знаци.
Фолиева киселина и неслучайни злополуки
Един от първите визуални експерименти, показващи, че епигенетиката наистина "има", е проведен от професор Ранди Гирт и постдокт, Робърт Уотърланд от университета Дюк, САЩ. Те въведоха гена за оцветяване на agouti със стандартни лабораторни мишки. Агути или както ги наричат \u200b\u200bоще „южноамерикански златни зайци“ са род бозайници от отряда на гризачите, които приличат на морски свинчета. Тези гризачи имат златна коса, понякога дори с оранжев нюанс. Интегрираният в генома на мишките „извънземен“ ген доведе до факта, че лабораторните мишки променят цвета си - косата им пожълтява. Въпреки това, генът agouti донесе на мишките някои неприятности: след въвеждането му животните получават излишно тегло, както и предразположение към диабет и рак. Такива мишки донасят нездравословно потомство, със същите разпореждания. Мишките бяха със златист цвят.

Сладка Агути (Dasyprocta aguti)
Обаче експериментаторите все пак успяха да „изключат“ лошия ген, без да прибягват до промяна на нуклеотидите на ДНК. Бременните жени от трансгенни мишки бяха поставени на специална диета, обогатена с фолиева киселина - източник на метилови групи. В резултат на това родените мишки вече не са златни, а естествени.
Защо фолиевата киселина е "работила"? Колкото повече метилови групи идват от храната към развиващия се ембрион, толкова повече възможности са достъпни за ензимите, катализиращи свързването на метилова група към ембрионалната ДНК, което инактивира възможния ефект на гена. Професор Гиртъл коментира своя експеримент и резултатите от него: „Епигенетиката доказва, че ние сме отговорни за целостта на нашия геном. Мислехме, че само гените определят кои сме. Днес знаем със сигурност: всичко, което правим, всичко, което ядем, пием или пушим, влияе върху експресията на нашите гени и гените на бъдещите поколения. Epigenetics ни предлага нова концепция за свободен избор. "

Професор Ранди Гиртъл и неговите трансгенни мишки
Не по-малко интересни резултати постигна Майкъл Мини от университета Макгил в Монреал, Канада, наблюдавайки плъхове, които отглеждат потомството си. Ако бебетата плъхове непрекъснато получават вниманието и грижите на майка си от раждането, тогава те растат спокойни по природа и доста интелигентни. Напротив, бебешките плъхове, чиито майки от самото начало пренебрегваха своето потомство и не се грижеха за него, израстваха страшно и нервно. Както се оказа, причината се крие в епигенетичните фактори: грижите за майките на плъхове контролират метилирането на гени, които са отговорни за реакцията на стрес рецепторите на кортизола, експресирани в хипокампуса. В друг експеримент, проведен малко по-късно, са разгледани същите фактори по отношение на хората. Експериментът е осъществен с помощта на магнитно-резонансно изображение и е насочен към установяване на всякаква връзка между грижите, предоставяни от родителите през детството, и организацията на мозъка като цяло. Оказа се, че грижата за майката играе ключова роля в този процес. Възрастен, страдащ в детска възраст от недостиг на майчината любов и внимание, е имал по-малък хипокамп от човек, чието детство е било проспериращо. Хипокампусът, като орган на лимбичната система на мозъка, е изключително универсален и подобен на компютърната оперативна памет: участва в формирането на емоции, определя силата на паметта, участва в процеса на преобразуване на краткосрочната памет в дългосрочна памет, свързан е с поддържане на вниманието, отговаря за скоростта на мисленето и в допълнение към много друго, определя предразположението на човек към редица психични заболявания, включително посттравматично стресово разстройство.

Ерик Нестлер, професор по невробиология в Института на Фридман по мозъка в Медицински център Маунт Синай, Ню Йорк, САЩ, изучава механизмите на депресия при експерименти със същите мишки. Спокойни и дружелюбни мишки бяха поставени в клетки с агресивни индивиди. Десет дни по-късно веднъж щастливи и спокойни мишки проявиха признаци на депресия: загубиха интерес към добрата храна, общуването с противоположния пол, станаха неспокойни и някои от тях ядоха постоянно и наддаваха на тегло. Понякога се оказа, че състоянието на депресия е стабилно и пълен изход е възможен само в случай на лечение с антидепресанти. Изследването на ДНК клетки на „системата за възнаграждение“ на мозъка на мишки от експеримента показа, че около 2000 гена променят картината на епигенетичната модификация и 1200 от тях увеличават степента на метилиране на хистон, което потиска активността на гена. Както се оказа, подобни епигенетични промени са открити в ДНК на мозъка на хора, починали, докато са в депресивно състояние. Разбира се, самата депресия е сложен многопараметричен процес, но очевидно може да „изключи“ гените от тази област на мозъка, която е свързана с наслаждаване на живота.
Но не всички хора са депресирани ... Същото се случи и с мишки - около една трета от гризачите избягаха в отрицателно състояние, докато са в стресова ситуация, въпреки факта, че резистентността присъства на нивото на гените. С други думи, на такива мишки липсват характерни епигенетични промени. Въпреки това, при „персистиращите“ мишки се наблюдават епигенетични промени в други гени на клетките на центъра на „системата на възнаграждение“ на мозъка. По този начин е възможна алтернативна епигенетична модификация, която изпълнява защитна функция, а устойчивостта към стрес не е резултат от липса на генетично обусловена зависимост, а влиянието на епигенетична програма, която е включена за защита и противодействие на травматичните ефекти върху психиката.
Nestler в своя доклад също казва следното: „Установихме, че сред„ защитните “гени, епигенетично модифицирани при устойчиви на стрес мишки, има много, чиято активност се възстановява до нормални при депресирани гризачи, които са били лекувани с антидепресанти. Това означава, че при хора, предразположени към депресия, антидепресантите упражняват ефекта си, наред с други неща, като стартират защитни епигенетични програми, които естествено работят при по-упорити лица. В този случай човек трябва да търси не само нови, по-мощни антидепресанти, но и вещества, които мобилизират защитните системи на организма. "
Ако в джоба ви има пакет цигари ....
За никого не е тайна, че от време на време в обществото възникват сериозни спорове по въпроса за тютюнопушенето. Привържениците на пакет цигари в джоба си обичат да повтарят за недоказаната вреда от този навик, но тук епигенетиката изведнъж излиза от крилата. Работата е там, че човек има важен р16 ген, който може да инхибира развитието на ракови тумори. Изследванията, проведени през последното десетилетие, показват, че някои вещества, съдържащи се в тютюневия дим, предизвикват изключване на p16, което, разбира се, не води до нищо добро. Но - това е интересно! - липса на протеин, за производството на който е отговорен р16, - стоп-клапан за процесите на стареене. Учени от Китай твърдят, че с правилното и безопасно изключване на гена е възможно да се забави загубата на мускулна маса и замъгляването на лещата.
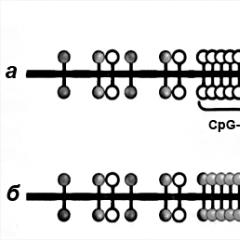
В нормално функционираща, здрава и пълноценна клетка, гените, които задействат процеса на образуване на онкологичен тумор, са неактивни. Това се дължи на метилирането на промотори (стартиращи сайтове за специфична транскрипция) на тези онкогени, наречени CpG острови. В ДНК азотните основи на цитозин (С) и гуанин (G) са свързани чрез фосфор, докато до един хиляди бази могат да бъдат разположени на един остров, а около 70% от промоторите на всички гени имат тези острови.

Тимин (червен), Аденин (зелен), Цитозин (син), Гуанин (черен) - мека играчки
Алкохол ацеталдехид, страничен продукт от преработката на етанол в човешкото тяло, както и някои вещества, съдържащи се в тютюна, инхибират образуването на метилови групи върху ДНК, която включва „спящи“ онкогени. Известно е, че до 60% от всички мутации в зародишните клетки се отчитат от CpG островчета, което нарушава правилната епигенетична регулация на генома. Метиловите групи влизат в тялото ни с храната, защото ние не произвеждаме нито фолиеви, нито метионинови аминокиселини - богати източници на CH3 групи. Ако нашата диета не съдържа тези аминокиселини, тогава нарушаването на процесите на метилиране на ДНК е неизбежно.
Развития и планове за бъдещето
През последните години епигенетиката успява значително да нарасне в технологиите. В рецензия на Масачузетския технологичен институт (САЩ) епигенетиката е посочена сред десетте най-важни технологии, които в близко бъдеще могат да променят света и да окажат най-голямо влияние върху човечеството.
Моше Зиф коментира настоящата ситуация: „За разлика от генетичните мутации, епигенетичните промени са потенциално обратими. Мутиралият ген най-вероятно никога няма да може да се върне към нормалното си състояние. Единственото решение в тази ситуация е да се акцизира или деактивира този ген във всички клетки, които го носят. Гени с нарушен модел на метилиране, с променен епигеном могат да бъдат върнати в нормално състояние и то съвсем просто. Вече съществуват епигенетични лекарства, например 5-азацитидин (търговското наименование е видаза), който е неметилиран аналог на цитидин, ДНК нуклеозид и РНК, която, когато е интегрирана в ДНК, намалява нивото на метилирането си. Това лекарство сега се използва срещу миелодиспластичен синдром, известен още като прелекемия. "
Немската компания Epigenomics вече пусна серия от скринингови тестове за диагностициране на рак на различни етапи от неговото развитие чрез епигенетични промени в организма на базата на метилиране на ДНК. Компанията продължава изследванията си в посока създаване на тестове за предразположение към различни видове онкология, като се стреми да „направи тестване на ДНК метилиране като стандартна практика в клинична лаборатория“. Други компании работят в същата посока: Roshe Pharmaceuticals, MethylGene, NimbleGen, Sigma-Aldrich, Epigentek. През 2003 г. стартира проектът за човешки епигеном, като част от него учените успяха да дешифрират променливи локуси за метилиране на ДНК върху три човешки хромозоми: 6, 20 и 22.

Епигенетични механизми, участващи в регулацията на генната експресия
Днес вече стана ясно, че изучаването на механизмите на "включените" гени дава на медицината много повече възможности за развитие от генната терапия. Планира се в бъдеще епигенетиката да може да ни разкаже за причините и процесите на развитието на определени заболявания с „генетично пристрастие“ - например болестта на Алцхаймер, болестта на Крон, диабетът ще помогне да се изучат механизмите, водещи до образуването на ракови тумори, развитието на психични разстройства и т.н.
На 19 февруари 2015 г. в списание Nature е публикувано списанието хроматинова организация Cell-of-origin хроматинът оформя мутационния пейзаж на рака. Група учени откриха, че моделът на мутация в ракова клетка корелира със структурата на хроматина. Какво означава това? Много. Често онколозите разработват методи за лечение на специфични видове тумори, но слабо идентифицират границите на конкретни случаи. Ако всеки вид раков тумор е свързан с променена структура на хроматина, ще стане ясно, че определен тумор се е развил от специфичен тип клетки и това напълно революционизира лечението на рака. Така наречените епигеномични карти ще помогнат да се определят причините за развитието на онкологията: туморните клетки „живеят“ с мутации, които са често срещани в ДНК на клетката.
Изучавайки болестта на Алцхаймер, учените отдавна са открили някои "генетични вариации", свързани с болестта. Те са слабо проучени поради факта, че се съдържат в частта от генома, която не кодира протеини. Биологът Манолис Келис от Масачузетския технологичен институт, изучавайки карти на епигенома на човешкия и миши мозък, стигна до извода, че тези „вариации“ по някакъв начин са свързани с имунната система. „Като цяло това е нещо, за което мнозина от научната общност интуитивно предполагаха, - казва Келис - но никой наистина не го показа на правилното ниво. " Изследванията продължават.
Въпреки големия брой творби, посветени на епигенетиката, в нея има повече от достатъчно черни дупки и бели петна. Международна организация, наречена Международен консорциум за човешки епигеноми (http://ihec-epigenomes.org/), има за цел да осигури безплатен достъп до човешки епигенетични материали за разработване на основни и приложни изследвания в области, свързани с епигенетиката. Плановете включват картиране на повече от 1000 типа клетки, проучване на промените в епигенома на хората, избрани за тестване за няколко години, с паралелно проучване на влиянието на външни фактори. „Тази работа ще ни заинтересува, поне през следващите десетилетия. Геномът е не само труден за четене, самият процес отнема много време “. - твърди Манолис Келис.
Освен това в момента се правят сериозни разработки в областта на алтернативните и ефективни методи за лечение на психични разстройства. Вече е доказано, че някои лекарствени вещества, които защитават хистон ацетил групите, чрез инактивиране на детоксикиращите ензими на ацетил групата, имат силно антидепресантно действие. Ензимът хистон деацетилаза, който катализира разцепването, може да бъде открит в клетки от различни области на мозъка, в много тъкани и органи, поради което лекарството поради безразборната си активност има страничен ефект. Изследователите изучават възможността за създаване на вещества, които потискат активността само на хистон деацетилаза в мозъка, които са отговорни за психическото състояние на човека („център за награди“). Но никой не си прави труда да се опита да идентифицира други протеини, участващи в епигенетичната модификация на хроматина на мозъчните клетки, или да идентифицира гени, които епигенетично модифицират при депресия (например тези, свързани със синтеза на рецептори на специфични невротрансмитери или сигнални протеини, които участват в активирането на невроните). Подобни изследвания ще дадат възможност за търсене или синтез на лекарства, които могат да инактивират тези специфични гени или техните продукти.
И накрая
„И така, как да живея сега?“ Водете здравословен начин на живот? Спешно да се запишете във фитнеса и да прегледате диетата си? “ - очакваш с нетърпение. Питър Спорк в своята книга „Четене между линиите на ДНК“, отговаря с малко хумор. Той казва, че все още не си струва рязко и трайно да зачеркнете вечерите на дивана от вашия живот и нездравословна храна, защото подобно разтърсване вероятно ще доведе до стрес, който може да повлияе и на епигенетиката. Основното е, че „вредността“ не се превръща в начин на живот или вроден навик. Епигенетиката, като маяк в бурното море на живота, ни показва, че тялото ни понякога преминава през критични периоди на развитие, когато епигените са чувствителни към дразнители от външната среда. Ето защо една жена, която очаква бебе, трябва редовно да приема фолиева киселина и да се предпазва от стрес и негативни ситуации.
А. и др. Хроматиновата организация с клетъчен произход оформя мутационния пейзаж на рака. Природа 518, стр. 360-364, 19 февруари 2015 г. http: //biochemies.cOM
), поради различната генна експресия в различни видове клетки, може да се осъществи развитието на многоклетъчен организъм, състоящ се от диференцирани клетки. Трябва да се отбележи, че много изследователи все още са скептично настроени към епигенетиката, тъй като тя позволява възможността за не-геномно наследяване като адаптивен отговор на промените в околната среда, което противоречи на доминиращата понастоящем генетична парадигма.
примери
Един пример за епигенетични промени в еукариотите е процесът на клетъчна диференциация. По време на морфогенезата тотипотентните стволови клетки образуват различни плюрипотентни клетъчни линии на ембриона, които от своя страна пораждат напълно диференцирани клетки. С други думи, една оплодена яйцеклетка - зигота - се диференцира в различни видове клетки, включително: неврони, мускулни клетки, епител, съдов ендотел и др., Чрез множество деления. Това се постига чрез активиране на някои гени и в същото време инхибиране на други, като се използват епигенетични механизми.
Втори пример може да бъде демонстриран върху полеви мишки. През есента, преди студено щракане, те се раждат с по-дълга и по-гъста козина, отколкото през пролетта, въпреки че вътрематочното развитие на мишки „пролет” и „есен” се случва на фона на почти идентични условия (температура, дневна светлина, влажност и др.). Проучванията показват, че сигнал, който предизвиква епигенетични промени, водещи до увеличаване на дължината на козината, е промяна в градиента на концентрация на мелатонин в кръвта (той намалява през пролетта и се увеличава през есента). По този начин епигенетичните адаптивни промени (увеличаване на дължината на косата) се предизвикват още преди настъпването на студеното време, адаптирането към което е полезно за организма.
Етимология и определения
Терминът "епигенетика" (както и "епигенетичен пейзаж") е предложен от Конрад Уодингтън през 1942 г. като производно от думите генетика и епигенеза. Когато Уодингтън въвежда термина, физическата същност на гените не е напълно известна, затова той го използва като концептуален модел за това как гените могат да взаимодействат със средата си при формирането на фенотипа.
Робин Холидей определи епигенетиката като „изучаване на механизмите на времевия и пространствен контрол на генната активност в процеса на развитие на организмите“. По този начин терминът "епигенетика" може да се използва за описание на всички вътрешни фактори, които влияят върху развитието на организма, с изключение на самата ДНК последователност.
Съвременната употреба на тази дума в научния дискурс е по-тясна. Гръцкият префикс epi- с една дума предполага фактори, които влияят „отгоре“ или „в допълнение“ на генетичните, което означава, че епигенетичните фактори действат в допълнение или в допълнение към традиционните молекулярни фактори на наследственост.
Сходството с думата „генетика“ породи много аналогии при употребата на термина. "Епигеном" е аналог на термина "геном" и определя общото епигенетично състояние на клетката. Метафората „генетичен код“ също е адаптирана и терминът „епигенетичен код“ се използва за описване на набор от епигенетични характеристики, които създават различни фенотипове в различни клетки. Терминът "епимутация" е широко използван, който означава промяна в нормалния епигеном, причинена от спорадични фактори и се предава в редица клетъчни поколения.
Молекулярна основа на епигенетиката
Молекулната основа на епигенетиката е доста сложна, въпреки факта, че тя не влияе върху структурата на ДНК, но променя активността на определени гени. Това обяснява защо в диференцираните клетки на многоклетъчния организъм се изразяват само гени, необходими за тяхната специфична активност. Характерна особеност на епигенетичните промени е, че те продължават по време на клетъчното делене. Известно е, че повечето епигенетични промени настъпват само в рамките на живота на един организъм. В същото време, ако в спермата или яйцеклетката настъпи промяна в ДНК, тогава някои епигенетични прояви могат да се предават от едно поколение на друго. В тази връзка възниква въпросът: могат ли епигенетичните промени в организма наистина да променят основната структура на неговата ДНК? (виж Еволюцията).
В рамките на епигенетиката широко се изучават такива процеси като: парамутация, генетична отметка, геномно отпечатване, инактивиране на Х-хромозома, позиционен ефект, майчин ефект, както и други механизми за регулиране на генната експресия.
Епигенетичните изследвания използват широк спектър от методи на молекулярна биология, включително хроматинови имунопреципитации (различни модификации на ChIP-на-чипа и ChIP-Seq), хибридизация in situ, чувствителна към рестрикция на метилиране на ензим, идентификация на ДНК аденин-метил-трансфераза (DamID) и бисулфит секвениране. Освен това използването на методи за биоинформатика (компютърна епигенетика) играе все по-важна роля.
Механизмите
ДНК метилиране и ремоделиране на хроматин
Епигенетичните фактори влияят на експресионната активност на определени гени на няколко нива, което води до промяна във фенотипа на клетката или организма. Един от механизмите на този ефект е ремодулацията на хроматин. Хроматинът е комплекс от ДНК с протеини от хистон: ДНК се навива на хистонови протеини, които са представени от сферични структури (нуклеозоми), което води до неговото уплътняване в ядрото. Интензивността на генната експресия зависи от плътността на хистоните в активно експресираните участъци на генома. Ремоделирането на хроматин е процес на активна промяна на нуклеозомата "плътност" и хистонен афинитет към ДНК. Постига се по двата начина, описани по-долу.
ДНК метилиране
Най-добре изученият епигенетичен механизъм досега е метилирането на цитозинови ДНК бази. Началото на интензивните изследвания за ролята на метилирането в регулацията на генетичната експресия, включително стареенето, е поставено още през 70-те години на миналия век с пионерски трудове на Б. Ванушин и Г. Д. Бердишев и др. Процесът на метилиране на ДНК включва свързване на метилова група към цитозин като част от CpG динуклеотид в позиция С5 на цитозиновия пръстен. Метилирането на ДНК е присъщо главно на еукариотите. При хората около 1% от геномната ДНК е метилирана. Три ензима, наречени ДНК метил трансферази 1, 3а и 3b (DNMT1, DNMT3a и DNMT3b), са отговорни за процеса на метилиране на ДНК. Предполага се, че DNMT3a и DNMT3b са de novo метилтрансферази, които формират модела на ДНК метилиране в ранните етапи на развитие, а DNMT1 извършва метилиране на ДНК в по-късните етапи от живота на организма. Функцията на метилиране е да активира / инактивира ген. В повечето случаи метилирането води до потискане на генната активност, особено при метилиране на неговите промоторни области, а деметилирането води до нейното активиране. Показано е, че дори незначителни промени в степента на метилиране на ДНК могат значително да променят нивото на генетична експресия.
Хистонови модификации
Въпреки че модификациите на аминокиселини в хистоните се срещат в цялата протеинова молекула, модификациите на N-опашката се срещат много по-често. Тези модификации включват: фосфорилиране, повсеместност, ацетилиране, метилиране, сумоилиране. Ацетилирането е най-изследваната модификация на хистоните. По този начин, ацетилирането с K14 и K9 ацетилтрансфераза на хистонови Н3 опасни лизини корелира с транскрипционната активност в този регион на хромозомата. Това се дължи на факта, че лизиновото ацетилиране променя положителния си заряд до неутрален, което прави връзката му с отрицателно заредени фосфатни групи в ДНК невъзможна. В резултат на това хистоните се изключват от ДНК, което води до кацане върху голата ДНК на комплекса SWI / SNF и други транскрипционни фактори, които задействат транскрипцията. Това е „цис” модел на епигенетична регулация.
Хистоните са в състояние да поддържат модифицираното си състояние и действат като матрица за модифициране на нови хистони, които се свързват с ДНК след репликация.
Механизмът на възпроизвеждане на епигенетични етикети е по-проучен за метилиране на ДНК, отколкото за хистонови модификации. И така, ензимът DNMT1 има висок афинитет към 5-метилцитозин. Когато DNMT1 открие „половин метилиран сайт“ (място, в което цитозинът се метилира само в една верига на ДНК), той метилира цитозин на втора верига в същото място.
приони
микро-РНК
Напоследък се обръща голямо внимание на изследването на ролята на малките смущаващи РНК (si-РНК) в регулаторните процеси на генетичната активност. Интерфериращите РНК могат да променят стабилността и транслацията на мРНК чрез моделиране на полизомни функции и хроматинова структура.
стойност
Епигенетичното наследяване в соматичните клетки играе решаваща роля за развитието на многоклетъчен организъм. Геномът на всички клетки е почти идентичен, в същото време многоклетъчният организъм съдържа различни диференцирани клетки, които възприемат сигналите на околната среда по различен начин и изпълняват различни функции. Именно епигенетичните фактори осигуряват „клетъчна памет“.
медицина
Както генетичните, така и епигенетичните явления оказват значително влияние върху човешкото здраве. Известни са няколко заболявания, които възникват поради нарушено метилиране на ген, както и поради хемизиготност към ген, податлив на геномно импринтиране. За много организми е доказана връзката на астетилирането / деацетилирането на хистон с продължителността на живота. Може би същите тези процеси влияят на продължителността на живота на хората.
еволюция
Въпреки че епигенетиката се разглежда главно в контекста на клетъчната памет, има и редица трансгенеративни епигенетични ефекти, при които генетичните промени се предават на потомците. За разлика от мутациите, епигенетичните промени са обратими и евентуално могат да бъдат насочени (адаптивни). Тъй като повечето от тях изчезват след няколко поколения, те могат да бъдат само временни адаптации. Активно се обсъжда и възможността за влияние на епигенетиката върху честотата на мутациите в определен ген. Показано е, че семейството APOBEC / AID на протеини на цитозин дезаминаза участва в генетична и епигенетична наследственост, използвайки подобни молекулярни механизми. В много организми са открити повече от 100 случая на трансгенеративни епигенетични явления.
Епигенетични ефекти при хората
Геномно отпечатване и свързани заболявания
Някои човешки заболявания са свързани с геномно отпечатване, явление, при което едни и същи гени имат различен модел на метилиране в зависимост от това от кой родител са. Най-известните случаи на заболявания, свързани с отпечатването, са синдром на Angelman и синдром на Prader-Willi. Причината за развитието на двете е частично заличаване в 15q региона. Това се дължи на наличието на геномно отпечатване на това място.
Трансгенеративни епигенетични ефекти
Маркъс Пембре и др. Откриха, че внуците (но не и внучките) на мъжете, които са гладували в Швеция през 19 век, са по-малко предразположени към сърдечно-съдови заболявания, но по-предразположени към диабет, което според автора е пример епигенетична наследственост.
Ракови заболявания и нарушения в развитието
Много вещества имат свойствата на епигенетични канцерогени: те водят до увеличаване на честотата на туморите, без да показват мутагенен ефект (например: диетилстилбестрол арсенит, хексахлоробензен и никелови съединения). Много тератогени, по-специално диетилстилбестрол, имат специфичен ефект върху плода на епигенетично ниво.
Промените в ацетилирането на хистон и метилирането на ДНК водят до развитието на рак на простатата, като променят активността на различни гени. Генетичната активност при рак на простатата може да бъде повлияна от храненето и начина на живот.
През 2008 г. Националният институт по здравеопазване на САЩ обяви, че 190 милиона долара ще бъдат изразходвани за изучаване на епигенетиката през следващите 5 години. Според някои изследователи, инициирали отпускането на средства, епигенетиката може да играе по-голяма роля в лечението на човешки заболявания, отколкото генетиката.
Епигеном и стареене
През последните години се натрупа голямо количество доказателства, че епигенетичните процеси играят важна роля в по-късните етапи от живота. По-специално, по време на стареенето се наблюдават големи промени в моделите на метилиране. Предполага се, че тези процеси са под генетичен контрол. Обикновено най-голямото количество метилирани цитозинови бази се наблюдава в ДНК, изолирана от ембриони или новородени животни, и това количество постепенно намалява с възрастта. Подобно понижение на нивото на метилиране на ДНК е установено при култивирани лимфоцити от мишки, хамстери и хора. Тя има систематичен характер, но може да бъде тъканна и генно-специфична. Например, Tra et al. (Tra et al., 2002) при сравняване на повече от 2000 локуса в Т-лимфоцити, изолирани от периферната кръв на новородените, както и средни и възрастни хора, беше установено, че 23 от тези локуси са подложени на хиперметилация и 6 хипометилация с възрастта, т.е. подобни промени в естеството на метилирането са открити и в други тъкани: панкреаса, белите дробове и хранопровода. Изразените епигенетични изкривявания са открити при пациенти с прогресията на Хътчинсън-Гилдфорд.
Смята се, че деметилирането с възрастта води до хромозомни пренареждания поради активирането на подвижните генетични елементи (MGEs), които обикновено се потискат от метилиране на ДНК (Barbot et al., 2002; Bennett-Baker, 2003). Систематичното намаляване на нивата на метилиране, свързано с възрастта, може поне отчасти да бъде причина за много сложни заболявания, които не могат да бъдат обяснени с класическите генетични вярвания. Друг процес, който протича в онтогенезата паралелно с деметилирането и засяга процесите на епигенетична регулация е хроматиновата кондензация (хетерохроматизация), която води до намаляване на генетичната активност с възрастта. В редица проучвания са установени и епигенетични промени, зависими от възрастта, в зародишните клетки; посоката на тези промени изглежда е специфична за ген.
литература
- Неса Кери, Епигенетика: как съвременната биология пренаписва представите ни за генетиката, болестите и наследствеността. - Ростов на Дон: Феникс, 2012. - ISBN 978-5-222-18837-8.
бележки
- Новите изследвания свързват обичайната модификация на РНК със затлъстяването
- http://woman.health-ua.com/article/475.html Епигенетична епидемиология на заболяванията, свързани с възрастта
- Холидей, Р., 1990. Механизми за контрол на генната активност по време на развитието. Biol. Rev. Cambr. Philos. Soc. 65, 431-471
- «Епигенетиката». Bio-Medicine.org. Получено 2011-05-21.
- V.L. Чандлър (2007). „Парамутация: от царевица до мишки.“ Клетка 128 (4): 641-645. doi: 10.1016 / j.cell.2007.02.02.007. PMID 17320501.
- Ян Сап, отвъд гена. 1987 Oxford University Press. Ян Сап, „Концепции за организация: лостът на цилиатните протозои“. В С. Гилбърт изд., Биология на развитието: всеобхватен синтез, (New York: Plenum Press, 1991), 229-258. Ян Сап, Генезис: Еволюцията на биологията Oxford University Press, 2003.
- Ояма, Сюзън; Пол Е. Грифитс, Ръсел Д. Грей (2001). MIT Press. ISBN 0-26-265063-0.
- Verdel et al, 2004
- Matzke, Birchler, 2005
- O.J. Рандо и К.Й. Verstrepen (2007). "Времеви интервали от генетично и епигенетично наследяване." Клетка 128 (4): 655-668. doi: 10.1016 / j.cell.2007.01.01.023. PMID 17320504.
- Jablonka, Eva; Гал Раз (юни 2009 г.). Трансгенерационно епигенетично наследство: разпространение, механизми и последствия за изследване на наследствеността и еволюцията. Тримесечният преглед на биологията 84 (2): 131-176. doi: 10.1086 / 598822. PMID 19606595.
- J.H.M. Knoll, R. D. Николс, Р.Е. Magenis, J.M. Graham Jr, M. Lalande, S.A. Latt (1989). „Синдромите на Angelman и Prader-Willi споделят обща делеция на хромозоми, но се различават по родителски произход на заличаването.“ American Journal of Medical Genetics 32 (2): 285-290. doi: 10.1002 / ajmg.1320320235.
Епигенетиката е сравнително нов клон на генетиката, който се нарича едно от най-важните биологични открития след откриването на ДНК. Някога наборът от гени, с които се раждаме, необратимо определя живота ни. Въпреки това, сега е известно, че гените могат да бъдат "включени" и "изключени", както и да се постигне по-голяма или по-малка експресия под въздействието на различни фактори на начина на живот. сайтът ще ви каже какво е епигенетиката, как работи и какво можете да направите, за да увеличите шансовете си за спечелване на „лотария за здраве“.
Епигенетика: Промени в начина на живот - ключ към промяна на гените
епигенетиката - Наука, която изучава процеси, водещи до промяна в генната активност без промяна на последователността на ДНК. Най-просто казано, епигенетиката изучава влиянието на външните фактори върху генната активност.
Проектът за човешкия геном идентифицира 25 000 гена в човешката ДНК. ДНК може да се нарече код, който тялото използва, за да изгради и възстанови себе си. Въпреки това, самите гени се нуждаят от „инструкции“, чрез които те определят необходимите действия и времето, за да ги изпълнят.
Епигенетични модификации и са самите инструкции. Има няколко вида такива модификации, но двата основни са тези, които засягат метилови групи (въглерод и водород) и хистони (протеини).
За да разберете как работят модификациите, представете си, че генът е крушка. Метиловите групи действат като светлинен превключвател (т.е. ген), а хистоните действат като регулатор на интензитета на светлината (т.е. те регулират нивото на генната активност). Така че, смята се, че човек има четири милиона от тези превключватели, които се активират под влияние на начина на живот и външни фактори.
Ключът към разбирането на влиянието на външните фактори върху активността на гените е наблюдението на живота на еднакви близнаци. Наблюденията показаха колко силни могат да бъдат промените в гените на такива близнаци, водещи различен начин на живот при различни външни условия. На теория идентичните близнаци трябва да имат „общи” заболявания, но това често не е така: алкохолизъм, болест на Алцхаймер, биполярно разстройство, шизофрения, диабет, рак, болест на Крон и ревматоиден артрит могат да се появят само при един близнак, в зависимост от различни фактори. Причината за това е епигенетичен дрейф - свързани с възрастта промени в генната експресия.
Тайните на епигенетиката: как факторите на начина на живот влияят върху гените
Проучванията в епигенетиката показват, че само 5% от генните мутации, свързани с болести, са напълно детерминирани; останалите 95% могат да бъдат повлияни чрез хранене, поведение и други фактори на околната среда. Програмата за здравословен начин на живот ви позволява да промените активността от 4000 на 5000 различни гени.
Ние не сме само сбора от гените, с които сме родени. Потребителят е човекът, той е този, който контролира гените си. Не е толкова важно какъв тип „генетични карти“ ви е дал - важно е какво ще правите с тях.
Епигенетиката е в начален стадий на развитие, предстои да научим много, но има информация за това кои основни фактори на начина на живот влияят на генната експресия.
- Хранене, сън и упражнения
Не е изненадващо, че храненето може да повлияе на състоянието на ДНК. Диета, наситена с преработени въглехидрати, води до "атаки" на ДНК с високи нива на кръвна глюкоза. От друга страна, увреждането на ДНК може да бъде обърнато:
- сулфорафан (намира се в броколи);
- куркумин (като част от куркума);
- епигалокатехин-3-галат (присъства в зелен чай);
- ресвератрол (намира се в гроздето и виното).
Що се отнася до съня, цяла седмица липса на сън се отразява негативно на активността на повече от 700 гена. Експресията на гените (117) има положителен ефект върху спорта.
- Стрес, връзки и дори мисли
Епигенетиката твърди, че не само такива "материални" фактори като диета, сън и спорт влияят на гените. Оказва се, че стресът, отношенията с хората и вашите мисли също са важни фактори, влияещи върху генната експресия. така:
- медитацията инхибира експресията на провъзпалителни гени, спомагайки за борба с възпалението, т.е. защита срещу болестта на Алцхаймер, рак, сърдечни заболявания и диабет; ефектът от тази практика е видим след 8 часа занимания;
- 400 научни проучвания показват, че благодарността, добротата, оптимизмът и различните техники, които използват ума и тялото, имат положителен ефект върху генната експресия;
- липса на активност, неправилно хранене, постоянни отрицателни емоции, токсини и лоши навици, както и наранявания и стресове предизвикват отрицателни епигенетични промени.
Продължителността на резултатите от епигенетичните промени и бъдещето на епигенетиката
Едно от най-стряскащите и противоречиви открития е, че епигенетичните промени се предават на бъдещите поколения, без да се променя последователността на гените. Д-р Мичъл Гайнър, автор на плана за генна терапия: Вземете под контрол генетичната съдба чрез хранене и начин на живот, смята, че генната експресия също е наследствена.
Според д-р Ранди Гертъл епигенетиката доказва, че ние също сме отговорни за целостта на нашия геном. Преди сме вярвали, че всичко зависи от гените. Епигенетиката дава яснота, че нашето поведение и навици могат да повлияят на генната експресия в бъдещите поколения.
Епигенетиката е сложна наука, която има огромен потенциал. Специалистите все още имат много работа, за да определят кои фактори от околната среда влияят на нашите гени, как можем (и можем) да обърнем болести или да ги предотвратим възможно най-ефективно.