Силно окисляване на алкени в алкална среда. Окислителни реакции на органични вещества
Както вече беше споменато, окисляването на органично вещество е въвеждането на кислород в неговия състав и (или) елиминирането на водорода. Редукцията е обратният процес (въвеждане на водород и елиминиране на кислород). Имайки предвид състава на алканите (СnH2n+2), можем да заключим, че те не са в състояние да участват в реакции на редукция, но могат да участват в реакции на окисление.
Алканите са съединения с ниски степени на окисление на въглерода и в зависимост от условията на реакцията те могат да бъдат окислени, за да образуват различни съединения.
При обикновени температури алканите не реагират дори със силни окислители (H2Cr2O7, KMnO4 и др.). Когато бъдат поставени в открит пламък, алканите горят. В този случай при излишък на кислород настъпва пълното им окисление до CO2, където има въглерод най-висока степенокисление +4 и вода. Изгарянето на въглеводороди води до разкъсване на всички C-C връзкии C-H и е придружено от освобождаване голямо количествотоплина (екзотермична реакция).
Общоприето е, че механизмът на окисление на алканите включва радикален верижен процес, тъй като самият кислород е слабо реактивен, за да се отдели водороден атом от алкан, е необходима частица, която ще инициира образуването на алкилов радикал, който; ще реагира с кислород, давайки перокси радикал. След това перокси радикалът може да отдели водороден атом от друга алканна молекула, за да образува алкилов хидропероксид и радикал.

Възможно е окисляване на алкани с атмосферен кислород при 100-150 ° C в присъствието на катализатор - манганов ацетат; тази реакция се използва в промишлеността. Окисляването възниква, когато въздушен поток се продуха през разтопен парафин, съдържащ манганова сол.
защото В резултат на реакцията се образува смес от киселини, те се отделят от нереагиралия парафин чрез разтваряне във воден алкален разтвор и след това се неутрализират с минерална киселина.
Този метод се използва директно в индустрията за получаване оцетна киселинаот n-бутан:
Окисляване на алкени
Реакциите на окисление на алкените са разделени на две групи: 1) реакции, при които се запазва въглеродният скелет, 2) реакции на окислително разрушаване на въглеродния скелет на молекулата при двойната връзка.
Окислителни реакции на алкени със запазване на въглеродния скелет
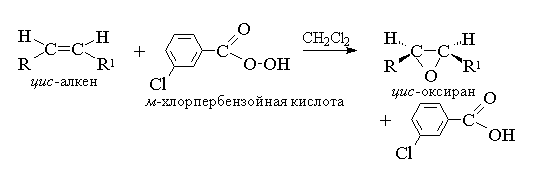
1. Епоксидиране (реакция на Прилежаев)
Ацикличните и цикличните алкени, когато реагират с перкиселини в неполярна среда, образуват епоксиди (оксирани).
Оксираните могат да бъдат получени и чрез окисляване на алкени с хидропероксиди в присъствието на катализатори, съдържащи молибден, волфрам и ванадий:

Най-простият оксиран, етиленовият оксид, се произвежда индустриално чрез окисление на етилен с кислород в присъствието на сребро или сребърен оксид като катализатор.

2. анти-хидроксилиране (хидролиза на епоксиди)
Киселинната (или алкалната) хидролиза на епоксидите води до отваряне на оксидния пръстен с образуването на трансдиоли.

В първия етап кислородният атом на епоксида се протонира, за да образува цикличен оксониев катион, който се отваря в резултат на нуклеофилната атака на водната молекула.
Основно катализираното отваряне на епоксиден пръстен също води до образуването на транс-гликоли.

3. син-Хидроксилиране
Един от най-старите методи за окисляване на алкени е реакцията на Вагнер (окисление с калиев перманганат). Първоначално окислението произвежда цикличен естер на манганова киселина, който се хидролизира до вицинален диол:

В допълнение към реакцията на Вагнер има друг метод за синхидроксилиране на алкени под действието на осмиев (VIII) оксид, предложен от Krige. Когато осмиевият тетроксид реагира с алкен в етер или диоксан, се образува черна утайка от естер на циклична осмиева киселина, осмат. Въпреки това, добавянето на OsO4 към множествената връзка се ускорява значително в пиридина. Получената черна осматна утайка лесно се разлага под действието на воден разтвор на натриев хидросулфит:

Калиевият перманганат или осмиевият (VIII) оксид окислява алкена до цис-1,2-диол.
Окислително разцепване на алкени
Окислителното разцепване на алкените включва реакции на тяхното взаимодействие с калиев перманганат в алкална или сярна киселина, както и окисление с разтвор на хромен триоксид в оцетна киселина или калиев дихромат и сярна киселина. Крайният резултат от такива трансформации е разцепването на въглеродния скелет на мястото на двойната връзка и образуването на карбоксилни киселини или кетони.
Монозаместените алкени с крайна двойна връзка се разцепват до карбоксилна киселина и въглероден диоксид:

Ако и двата въглеродни атома при двойна връзка съдържат само една алкилова група, тогава се образува смес от карбоксилни киселини:

Но ако алкенът, тетразаместен при двойната връзка, е кетон:

Много по-голямо подготвително значение има реакцията на озонолиза на алкени. В продължение на много десетилетия тази реакция служи като основен метод за определяне на структурата на изходния алкен. Тази реакциясе извършва чрез преминаване на ток от разтвор на озон в кислород, разтвор на алкен в метиленхлорид или етилацетат при -80 ... -100 ° C. Механизмът на тази реакция е установен от Krige:


Озонидите са нестабилни съединения, които се разлагат експлозивно. Има два начина за разлагане на озонидите - окислителен и редуктивен.
По време на хидролиза озонидите се разграждат до карбонилни съединения и водороден пероксид. Водородният пероксид окислява алдехидите до карбоксилни киселини - това е окислително разлагане:

Много по-важно е редуктивното разцепване на озонидите. Продуктите на озонолизата са алдехиди или кетони, в зависимост от структурата на изходния алкен:
В допълнение към горните методи има друг метод, предложен през 1955 г. от Lemieux:
При метода на Lemieux няма трудоемки процедури за отделяне на манганов диоксид, т.к. диоксидът и манганатът отново се окисляват от периодат до перманганатен йон. Това позволява да се използват само каталитични количества калиев перманганат.
Изберете основната въглеродна верига в молекулата. Първо, трябва да е най-дълъг. Второ, ако има две или повече вериги с еднаква дължина, тогава се избира най-разклонената. Например в една молекула има 2 вериги с еднакъв брой (7) С атоми (маркирани в цвят):
В случай (а) веригата има 1 заместител, а в (б) - 2. Следователно трябва да изберете вариант (б).
1. Номерирайте въглеродните атоми в главната верига, така че С атомите, свързани със заместителите, да получат възможно най-ниските числа. Следователно номерирането започва от края на веригата, който е най-близо до клона. Например:

Наименувайте всички радикали (заместители), като посочите отпред числата, показващи тяхното местоположение в главната верига. Ако има няколко еднакви заместителя, тогава за всеки от тях се изписва номер (местоположение), разделен със запетая, а броят им се обозначава с префикси ди-, три-, тетра-, пента- и т.н. (Например, 2,2-диметилили 2,3,3,5-тетраметил).
Поставете имената на всички заместители в азбучен ред (както е установено от последните правила на IUPAC).
Назовете основната верига от въглеродни атоми, т.е. съответния нормален алкан.
По този начин, в името на разклонен алкан, коренът + наставката е името на нормален алкан (гръцка цифра + наставка "an"), префиксите са числа и имена на въглеводородни радикали. Пример за изграждане на заглавие:

Chem. Светци на алканитеКрекинг на алкани.Крекингът е процес на термично разлагане на въглеводороди, който се основава на реакциите на разделяне на въглеродната верига на големи молекули с образуването на съединения с по-къса верига. Изомеризация на алканиАлканите с нормална структура под въздействието на катализатори и при нагряване могат да се трансформират в разклонени алкани, без да променят състава на молекулите, т.е. влизат в реакции на изомеризация. Тези реакции включват алкани, чиито молекули съдържат най-малко 4 въглеродни атома. Например, изомеризацията на n-пентан в изопентан (2-метилбутан) се извършва при 100°C в присъствието на катализатор от алуминиев хлорид:
 Изходният материал и продуктът от реакцията на изомеризация имат еднакви молекулни формули и са структурни изомери (изомерия на въглероден скелет).
Изходният материал и продуктът от реакцията на изомеризация имат еднакви молекулни формули и са структурни изомери (изомерия на въглероден скелет).
Дехидрогениране на алкани
Когато алканите се нагряват в присъствието на катализатори (Pt, Pd, Ni, Fe, Cr 2 O 3, Fe 2 O 3, ZnO), техните каталитични дехидрогениране– отнемане на водородни атоми поради разкъсване на С-Н връзки.
Структурата на продуктите на дехидрогениране зависи от условията на реакцията и дължината на основната верига в изходната алканна молекула.
1. Нисши алкани, съдържащи от 2 до 4 въглеродни атома във веригата, когато се нагряват над Ni катализатор, отстраняват водорода от съседнивъглеродни атоми и се превръщат в алкени:
Заедно с бутен-2тази реакция произвежда бутен-1 CH2=CH-CH2-CH3. В присъствието на катализатор Cr 2 O 3 /Al 2 O 3 при 450-650 °C от н-получава се и бутан бутадиен-1,3СН2 =СН-СН=СН2.
2. За получаване се използват алкани, съдържащи повече от 4 въглеродни атома в главната верига цикличенвръзки. Това се случва дехидроциклизация– реакция на дехидрогениране, която води до затваряне на веригата в стабилен цикъл.
Ако основната верига на молекулата на алкан съдържа 5 (но не повече) въглеродни атома ( н-пентан и неговите алкилови производни), тогава при нагряване върху Pt катализатор, водородните атоми се отделят от крайните атоми на въглеродната верига и се образува петчленен цикъл (циклопентан или негови производни):

Алканите с основна верига от 6 или повече въглеродни атома също претърпяват дехидроциклизация, но винаги образуват 6-членен пръстен (циклохексан и неговите производни). При реакционни условия този цикъл претърпява допълнително дехидрогениране и се превръща в енергийно по-стабилен бензенов пръстен на ароматен въглеводород (арен). Например:

Тези реакции са в основата на процеса реформиране– преработка на петролни продукти за получаване на арени ( ароматизираненаситени въглеводороди) и водород. Трансформация н-алкани в арената води до подобряване на устойчивостта на детонация на бензина.
Алкините с нетерминална тройна връзка служат като потенциален източник за синтеза на 1,2-дикетони под действието на подходящ окислител. Все още обаче не е намерен универсален реагент, който да предизвиква окисляването на тройна въглерод-въглеродна връзка до 1,2-дикарбонилна група. RuO 4, рутениев (VIII) оксид, предложен за тази цел, е твърде скъп и често причинява допълнително окислително разрушаване на 1,2-дикетони до карбоксилни киселини. Когато двузаместените ацетилени взаимодействат с такива силни окислители като калиев перманганат, само в напълно неутрална среда при pH 7–8 при 0 ° C окислението може да бъде спряно на етапа на образуване на α-дикетон. Например стеароловата киселина при pH 7,5 се окислява до α-дикетон. В повечето случаи окислението е придружено от разцепване на тройната връзка за образуване на карбоксилни киселини:

Добивът на продукти от окислителното разрушаване на алкините е малък и тази реакция не играе съществена роля в органичния синтез. Използва се единствено за доказване на структурата на естествено срещащата се ацетиленова киселина, открита в листата на тропическите растения в Централна Америка. При окислителното му разрушаване са изолирани две киселини – лауринова и адипинова. Това означава, че изходната киселина е 6-октадецинова киселина с нормален въглероден скелет от седемнадесет въглеродни атома:
Много по-важно е окислителното свързване на 1-алкини, катализирано от медни соли (реакция на Глейзър-Еглинтън). През 1870 г. Glaser открива, че суспензия на меден (I) ацетилид в алкохол се окислява от атмосферния кислород до образуване на 1,3-диини:

За окисляването на медни (I) ацетилениди, калиевият хексацианоферат (III) K3 в DME или DMF е по-ефективен като окислител. През 1959 г. Еглинтън предлага много по-удобна модификация на окислителната кондензация на алкини. Алкинът се окислява с меден (II) ацетат в пиридинов разтвор при 60–70 °C. Модификацията на Eglinton се оказа изключително полезна за синтеза на макроциклични полиини от ,-диини. Като илюстрация представяме синтеза на два циклополиина по време на окислителната кондензация на хексадиин-1,5 (F. Sondheimer, 1960):

Единият от полиините е продукт на циклотримеризация, другият е продукт на циклотетрамеризация на оригиналния хесадиин-1,5. Тримерът служи като изходен реагент за синтеза на ароматен -анулен (за повече информация относно анулините вижте Глава 12). По същия начин при същите условия на нонадиин-1,8 се получава неговият димер - 1,3,10,12-циклооктадекатетраен, заедно с тример, тетрамер и пентамер:

За получаване на несиметрични диини се използва кондензация на халоацетилени с алкин-1 (терминален алкин) в присъствието на медни (I) соли и първичен амин (комбинация според Кадио-Ходкевич, 1957):

Изходните бромоалкини се получават чрез действието на натриев хипобромит върху алкини-1 или от литиеви и бромни ацетилениди:
Органомедното производно на крайния алкин се генерира директно в реакционната смес на Cu 2 Cl 2 и алкин-1.
6.3.4. Реакции на електрофилно присъединяване към тройна връзка
Реакциите на електрофилно присъединяване към тройна връзка са сред най-типичните и важни реакции на алкините. За разлика от електрофилното присъединяване към алкени, синтетичното приложение на тази голяма група реакции е далеч по-напред от развитието на теоретичните идеи за неговия механизъм. Въпреки това през последните двадесет години ситуацията се промени значително и в момента това е една от бързо развиващите се области на физическата органична химия. HOMO на алкин е разположен по-ниско от HOMO на алкен (Глава 2) и това обстоятелство предопределя в преобладаващата част от случаите по- ниска скоростдобавяне на електрофилен агент към алкин срещу алкен. Друг фактор, който определя разликата в реактивоспособността на алкините и алкените в реакциите на електрофилно присъединяване, е относителната стабилност на междинните съединения в резултат на добавянето на електрофилен вид към тройни и двойни връзки. Когато електрофилен Н + или Е + вид се прикрепи към двойна връзка, се образува цикличен или отворен карбокатион (Глава 5). Добавянето на Н+ или Е+ към тройна връзка води до образуването на отворен или цикличен винилов катион. В линеен отворен винилов катион централният въглероден атом се намира в sp-хибридно състояние, докато е празно Р-орбитала е ортогонална на -връзката. Тъй като sp-хибридният въглероден атом на виниловия катион има по-висока електроотрицателност в сравнение с sp 2-хибриден атом на алкиловия катион, виниловият катион трябва да бъде по-малко стабилен в сравнение с алкиловия катион:

Данните от квантово-механичните изчисления, както и термодинамичните данни за газовата фаза, получени с помощта на масспектрометрия при високо налягане и циклотронна резонансна спектроскопия, са в пълно съответствие с тези съображения. В табл 6.3 показва термодинамични данни за образуването на редица карбокатиони и въглеводороди, свързани с газовата фаза при 25 °C.
|
Карбокатион |
Δ н f ˚ kcal/mol |
|
| |
|
| |
|
|
От представените данни в табл. 6.3, следва, че виниловият катион е с 47 kcal/mol по-малко стабилен от етиловия катион, съдържащ същия брой атоми. Същото заключение може да се направи от енталпията на йонизация в газовата фаза CH 3 CH 2 Cl и CH 2 =CHCl:
Лесно е да се види, че комбинацията от двата фактора - по-високата енергия на виниловия катион и ниско разположената HOMO на алкина - представлява по-ниска реактивност на алкините в сравнение с алкените в реакции на електрофилно присъединяване. В табл 6.4 съдържа сравнителни данни за добавянето на халогени, сулфен и селенилхлориди, трифлуорооцетна киселина и вода към различни алкени и алкини, които не съдържат активираща или дезактивираща функционална група.
Таблица 6.4
Сравнителна характеристика на алкини и алкени
в реакции на електрофилно присъединяване
|
Субстрати |
К алкен/К алкин |
|
|
Бромиране в оцетна киселина |
CH 2 CH 2 /HCCH C 4 H 9 CH = CH 2 / C 4 H 9 CCH C 6 H 5 CH=CH 2 /C 6 H 5 CCH | |
|
Хлориране в оцетна киселина |
C 6 H 5 CH=CH 2 /C 6 H 5 CCH C 4 H 9 CH=CH 2 /C 6 H 5 CCH С 2 Н 5 С=СНС 2 Н 5 /С 2 Н 5 ССС 2 Н 5 | |
|
Добавяне на 4-хлорофенилсулфен хлорид П-ClС 6 H 4 SeCl |
CH 2 =CH 2 /HCCH C 4 H 9 CH = CH 2 / C 4 H 9 CCH C 6 H 5 CH=CH 2 /C 6 H 5 CCH | |
|
Добавяне на фенилселенов хлорид C 6 H 5 SeCl |
CH 2 =CH 2 /HCCH C 4 H 9 CH = CH 2 / C 4 H 9 CCH C 6 H 5 CH=CH 2 /C 6 H 5 CCH | |
|
Добавяне на трифлуорооцетна киселина |
C 4 H 9 CH = CH 2 / C 4 H 9 CCH C 6 H 5 CH=CH 2 /C 6 H 5 CCH C 2 H 5 CH = CH 2 / C 2 H 5 CCH | |
|
Киселинно катализирана хидратация |
C 4 H 9 CH = CH 2 / C 4 H 9 CCH С 2 Н 5 СН=СНС 2 Н 5 /С 2 Н 5 ССС 2 Н 5 C 6 H 5 CH=CH 2 /C 6 H 5 CCH |
От тези данни следва, че само добавянето на киселинни агенти и вода към тройни и двойни връзки става с подобни скорости. Добавянето на халогени, сулфенхлориди и редица други реагенти към алкените става 10 2 - 10 5 пъти по-бързо, отколкото към алкините. Това означава, че въглеводородите, съдържащи неконюгирани тройни и двойни връзки, селективно добавят тези реагенти при двойната връзка, например:

Данните за сравнителната хидратация на алкини и алкени трябва да се третират с повишено внимание, тъй като хидратацията на алкините изисква катализа на живачни (II) йони, която е неефективна за добавяне на вода към двойната връзка. Следователно данните за хидратацията на тройните и двойните връзки, строго погледнато, не са сравними.
Добавянето на халогени, водородни халиди, сулфенхлориди и други електрофилни агенти може да се извърши на етапи, което лесно се илюстрира със следните примери:



4.5. Окисляване на алкени
Препоръчително е реакциите на окисление на алкените да се разделят на две големи групи: реакции, при които въглеродният скелет се запазва и реакции на окислително разрушаване на въглеродния скелет на молекулата при двойната връзка. Първата група реакции включва епоксидиране, както и хидроксилиране, което води до образуването на вицинални диоли (гликоли). В случай на циклични алкени, хидроксилирането произвежда вицинал транс- или цис-диоли. Друга група включва озонолиза и реакции на изчерпателно окисляване на алкени, водещи до образуването на различни видове карбонилни съединения и карбоксилни киселини.
4.5.a. Окислителни реакции на алкени със запазване на въглеродния скелет
1. Епоксидиране (реакция на Н.А. Прилежаев, 1909 г.)
Ацикличните и цикличните алкени, когато реагират с перкиселини (перакиселини) RCOOOH в неполярна, индиферентна среда, образуват епоксиди (оксирани), поради което самата реакция се нарича реакция на епоксидиране.
Според съвременната номенклатура IUPAC- тричленен пръстен с един кислороден атом се нарича оксиран.
Епоксидирането на алкените трябва да се разглежда като синхронен, координиран процес, в който не участват йонни междинни съединения като хидроксилния катион ОН+. С други думи, епоксидирането на алкените е процес син- прикрепване на един кислороден атом към двойна връзка с пълно запазване на конфигурацията на заместителите при двойната връзка.

За епоксидирането е предложен механизъм, характерен за съгласувани процеси.

Тъй като атаката на двойната връзка от кислородния атом на перкиселината е еднакво вероятна от двете страни на равнината на двойната връзка, получените оксирани са или мезо-форми или смеси от енантиомери. Като епоксидиращи агенти се използват следните перкиселини: пербензоена, м-хлоропербензоена, моноперфталова, пероцетна, трифлуоропероцетна и перформинова. Перкиселините от ароматната серия се използват под формата на индивидуални реагенти, докато перкиселините от алифатната серия - CH 3 CO 3 H, CF 3 CO 3 H и HCO 3 H не се изолират в индивидуална форма, а се използват след образуването им в взаимодействието на 30% или 90% водороден прекис и съответната карбоксилна киселина. Пербензоин и м-хлоропербензоена киселина се получава чрез окисление на бензоена и м-хлорбензоени киселини със 70% водороден прекис в разтвор на метансулфонова киселина или от киселинните хлориди на тези киселини и водороден прекис.


Моноперфталовата киселина се получава по подобен метод от фталов анхидрид и 30% водороден прекис.

Първоначално пербензоена или моноперфталова киселина се използват за получаване на оксирани (епоксиди):

В момента най-често използваният за епоксидиране е м-хлорпербензоена киселина. За разлика от други перкиселини, той е стабилен за дълго време (до 1 година) и е абсолютно безопасен за работа. Добиви на оксирани, получени от окислението на ациклични и циклични алкени м-хлоропербензоена киселина в разтвор на метиленхлорид, хлороформ или диоксан обикновено са доста високи.



Перкиселините често се генерират директно в реакционна смес от 90% водороден пероксид и карбоксилна киселина в метиленхлорид.


Алкените с двойна връзка, свързана с карбонилна група или друг акцепторен заместител, са неактивни и за тяхното окисление е по-добре да се използват по-силни окислители, като трифлуороцетна киселина, получена от трифлуороцетен анхидрид и 90% водороден прекис в метиленхлорид. Най-простият оксиран, етиленовият оксид, се произвежда индустриално чрез окисление на етилен с кислород в присъствието на сребро като катализатор.

2. анти-Хидроксилиране
Тричленният пръстен на оксираните лесно се отваря под въздействието на голямо разнообразие от нуклеофилни реагенти. Тези реакции ще бъдат обсъдени подробно в раздела за ациклични и циклични етери. Тук ще бъде разгледана само хидролизата на оксираните. Хидролизата на оксираните се катализира както от киселини, така и от основи. И в двата случая се образуват вицинални диоли, т.е. гликоли. При киселинна катализа, в първия етап, оксирановият кислороден атом се протонира, за да образува цикличен оксониев катион, който се отваря в резултат на нуклеофилната атака на водна молекула:

Ключовата стъпка в отварянето на пръстена, която определя скоростта на целия процес, е нуклеофилната атака от вода върху протонираната форма на оксирана. Механично, този процес е подобен на отварянето на бромониев йон при нуклеофилна атака от бромиден йон или друг нуклеофилен агент. От тези позиции стереохимичният резултат трябва да бъде образуването транс-гликоли по време на разграждането на циклични епоксиди. Наистина, по време на киселинно катализираната хидролиза на циклохексен оксид или циклопентен оксид, изключително транс-1,2-диоли.

По този начин, двуетапният процес на епоксидиране на алкени, последван от киселинна хидролиза на епоксида като цяло съответства на реакцията анти-хидроксилиране на алкени.
И двата етапа анти-хидроксилирането на алкени може да се комбинира, ако алкенът се третира с воден 30-70% водороден пероксид в мравчена или трифлуорооцетна киселина. И двете киселини са достатъчно силни, за да предизвикат отварянето на оксирановия пръстен.

Основно катализираното отваряне на оксирановия пръстен също води до образуването на цикличен транс-гликоли.

Следователно, двуетапният процес на епоксидиране на алкени, последван от алкална хидролиза на епоксиди, също е реакция анти-хидроксилиране на алкени.
3. син-Хидроксилиране
Някои соли и оксиди на преходни метали в по-високи степени на окисление са ефективни реагенти син-хидроксилиране на двойната връзка на алкен, когато и двете хидроксилни групи се добавят към една и съща страна на двойната връзка. Окисляването на алкени с калиев перманганат е един от най-старите методи син-хидроксилирането на двойна връзка продължава да се използва широко въпреки присъщите му ограничения. цис-1,2-циклохександиолът е получен за първи път от V.V. Марковников през 1878 г. чрез хидроксилиране на циклохексен с воден разтвор на калиев перманганат при 0 0 С.

По-късно този метод е разработен в трудовете на руския учен Е.Е. Вагнер, следователно син-хидроксилиране на алкени под действието на воден разтвор на калиев перманганат се нарича реакция на Вагнер. Калиевият перманганат е силен окислител, който може не само да хидроксилира двойната връзка, но и да разцепи получения вицинален диол. За да се избегне по-нататъшното разграждане на гликолите, доколкото е възможно, реакционните условия трябва да бъдат внимателно контролирани. Добивите на гликоли обикновено са ниски (30-60%). Най-добри резултати се постигат чрез хидроксилиране на алкени в леко алкална среда (pH ~ 8 9) при 0-5 0 C с разреден 1% воден разтвор на KMnO 4.


Първоначално окислението на алкени с калиев перманганат произвежда цикличен естер на манганова киселина, който веднага се хидролизира до вицинален диол.

Цикличният естер на манганова киселина като междинен продукт не е изолиран, но неговото образуване следва от експерименти с белязан 18 O калиев перманганат: двата кислородни атома в гликола се оказват белязани по време на окисляването на алкена KMn 18 O 4. Това означава, че и двата кислородни атома се прехвърлят от окислителя, а не от разтворителя - вода, което е в добро съответствие с предложения механизъм.
Друг метод син-хидроксилиране на алкени под въздействието на осмиев (VIII) оксид OsO 4 е предложено от R. Kriege през 1936 г. Осмиевият тетроксид е безцветно, летливо, кристално вещество, силно разтворимо в етер, диоксан, пиридин и други органични разтворители. Когато осмиевият тетроксид реагира с алкени в етер или диоксан, се образува черна утайка от естер на циклична осмиева киселина - осмат, който лесно може да бъде изолиран в индивидуална форма. Добавянето на OsO 4 към двойната връзка се ускорява значително в разтвор в пиридин. Разграждането на осматите до вицинални гликоли се постига чрез действието на воден разтвор на натриев хидросулфит или сероводород.

Продуктови добиви син-хидроксилирането на алкени при този метод е значително по-високо, отколкото при използване на перманганат като окислител. Важно предимство на метода на Krige е липсата на продукти от окислително разцепване на алкени, което е характерно за перманганатното окисление.


Осмиевият тетроксид е много скъп и труден за получаване реагент, освен това е токсичен. Следователно осмиевият (VIII) оксид се използва при синтеза на малки количества труднодостъпни вещества, за да се получи най-висок добив на диол. За опростяване син-хидроксилиране на алкени под въздействието на OsO 4, е разработена техника, която позволява използването само на каталитични количества от този реагент. Хидроксилирането на алкени се извършва с помощта на водороден пероксид в присъствието на OsO 4, например:

За да завършим този раздел, представяме стереохимичните връзки между алкена цис- или транс-конфигурация и конфигурацията на получения вицинален диол, който може да бъде цис- или транс-изомер, еритро- или трио- форма, мезо- или Д,Л-форма в зависимост от заместителите в алкена:

Подобни стереохимични връзки се наблюдават и при други реакции син- или анти- добавяне на многократни връзки на водород, халогеноводороди, вода, халогени, борни хидриди и други реагенти.
Редокс реакции, включващи органична материя
Склонността на органичните съединения да се окисляват е свързана с наличието множествени връзки, функционални групи, водородни атоми при въглеродния атом, съдържащ функционалната група.
Последователното окисление на органичните вещества може да бъде представено като следната верига от трансформации:
Наситен въглеводород → Ненаситен въглеводород → Алкохол → Алдехид (кетон) → Карбоксилна киселина → CO 2 + H 2 O
Генетичната връзка между класовете органични съединения е представена тук като поредица от редокс реакции, които осигуряват прехода от един клас органични съединения към друг. Той се допълва от продуктите на пълното окисление (изгаряне) на всеки представител на класовете органични съединения.
Зависимост на редокс капацитета на органично вещество от неговата структура:
Повишената склонност на органичните съединения към окисляване се дължи на наличието на вещества в молекулата:
- множество облигации(ето защо алкените, алкините и алкадиените се окисляват толкова лесно);
- определени функционални групи, способни лесно да се окисляват (–-SH, –OH (фенолни и алкохолни), – NH 2 ;
- активирани алкилови групи, разположени в съседство с множество връзки. Например пропенът може да се окисли до ненаситения алдехид акролеин с атмосферен кислород в присъствието на водна пара върху бисмут-молибденови катализатори.
H 2 C=CH−CH 3 → H 2 C=CH−COH
А също и окисляването на толуен до бензоена киселина с калиев перманганат в кисела среда.
5C 6 H 5 CH 3 +6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
- присъствието на водородни атоми при въглероден атом, съдържащ функционална група.
Пример за това е реактивността в реакциите на окисление на първични, вторични и третични алкохоли чрез окислителна реактивност.
Въпреки факта, че по време на всяка окислително-редукционна реакция възникват както окисление, така и редукция, реакциите се класифицират в зависимост от това какво се случва директно с органичното съединение (ако се окислява, говорим за процес на окисление, ако се редуцира, говорим за процес на редукция ) .
По този начин, при реакцията на етилен с калиев перманганат, етиленът ще се окисли и калиевият перманганат ще се редуцира. Реакцията се нарича окисляване на етилен.
Използването на понятието „степен на окисление“ (CO) в органичната химия е много ограничено и се прилага предимно при изготвянето на уравнения за редокс реакции. Въпреки това, като се има предвид, че повече или по-малко постоянен състав на реакционните продукти е възможен само при пълно окисление (изгаряне) на органични вещества, целесъобразността на подреждането на коефициенти в реакциите на непълно окисление изчезва. Поради тази причина човек обикновено се ограничава до съставянето на диаграма на трансформациите на органичните съединения.
При учене сравнителни характеристикина неорганични и органични съединения се запознахме с използването на степен на окисление (s.o.) (в органичната химия, предимно въглерод) и методите за определянето му:
1) изчисляване на средна с.о. въглерод в молекула на органична материя:
-8/3 +1
Този подход е оправдан, ако по време на реакцията в органичната материя всички химически връзки(изгаряне, пълно разлагане).
2) определение за s.o. всеки въглероден атом:
В този случай степента на окисление на всеки въглероден атом в органично съединение е равна на алгебричната сума от числата на всички връзки с атоми на по-електроотрицателни елементи, взети под внимание със знака "+" на въглеродния атом и брой връзки с водородни атоми (или друг по-електроположителен елемент), взети под внимание със знака "-" при въглеродния атом. В този случай връзките със съседни въглеродни атоми не се вземат предвид.
Като прост пример, нека определим степента на окисление на въглерода в молекула метанол.
![]()
Въглероден атом е свързан с три водородни атома (тези връзки се броят със знака „–“), а една връзка е свързана с кислороден атом (брои се със знак „+“). Получаваме: -3 + 1 = -2 Така степента на окисление на въглерода в метанола е -2.
Изчислената степен на окисление на въглерода, макар и условна стойност, показва естеството на изместването на електронната плътност в молекулата, а нейната промяна в резултат на реакцията показва протичащия редокс процес.
Нека изясним в какви случаи е по-добре да използваме един или друг метод.
Процесите на окисление, изгаряне, халогениране, нитриране, дехидрогениране и разлагане се класифицират като редокс процеси.
При преминаване от един клас органични съединения към друг Иувеличаване на степента на разклоняване на въглеродния скелет молекули на съединения в отделен клас Степента на окисление на въглеродния атом, отговорен за редукционната способност на съединението, се променя.
Органични вещества, чиито молекули съдържат въглеродни атоми с максимум(- и +) стойности на CO(-4, -3, +2, +3), влизат в пълна реакция на окисление-горене, но устойчив на леки и средни окислители.
Вещества, чиито молекули съдържат въглеродни атоми в CO -1; 0; +1, окисляват се лесно, редукционните им способности са близки, следователно непълното им окисление може да се постигне поради един от известните окислители с ниска и средна якост. Тези вещества могат да проявяват двойна природа, действайки като окислител, точно както е присъщо на неорганичните вещества.
Когато пишете уравнения за реакциите на горене и разлагане на органични вещества, е по-добре да използвате средната стойност на d.o. въглерод.
Например:
![]()
Нека създадем пълно уравнение за химическа реакция, използвайки метода на баланса.
Средна стойност на степента на окисление на въглерода в n-бутан:
Степента на окисление на въглерода във въглероден оксид (IV) е +4.
Нека създадем електронна балансова диаграма:

Обърнете внимание на първата половина на електронния баланс: въглеродният атом има частична d.o. знаменателят е 4, така че изчисляваме трансфера на електрони, използвайки този коефициент.
Тези. преходът от -2,5 към +4 съответства на прехода 2,5 + 4 = 6,5 единици. защото Включени са 4 въглеродни атома, тогава 6,5 · 4 = 26 електрона ще бъдат отдадени общо от въглеродните атоми на бутана.
Като се вземат предвид намерените коефициенти, уравнението за химическата реакция на изгаряне на n-бутан ще изглежда така:
Можете да използвате метода за определяне на общия заряд на въглеродните атоми в молекула:
(4 ° С) -10 …… → (1 ° С) +4 , като вземем предвид, че броят на атомите преди и след знака = трябва да е еднакъв, изравняваме (4° С) -10 …… →[(1 ° С) +4 ] · 4
Следователно преходът от -10 до +16 включва загуба на 26 електрона.
В други случаи определяме стойностите на s.o. всеки въглероден атом в съединението, като се обръща внимание на последователността на заместване на водородните атоми при първични, вторични, третични въглеродни атоми:


Първо, процесът на заместване протича при третичните въглеродни атоми, след това при вторичните въглеродни атоми и накрая при първичните въглеродни атоми.
Алкени
Окислителните процеси зависят от структурата на алкена и реакционната среда.
1. По време на окисляването на алкени с концентриран разтвор на калиев перманганат KMnO 4 в кисела среда (твърдо окисление) σ- и π-връзките се разрушават с образуването на карбоксилни киселини, кетони и въглероден оксид (IV). Тази реакция се използва за определяне на позицията на двойната връзка.
а) Ако двойната връзка е в края на молекулата (например в бутен-1), тогава един от продуктите на окисление е мравчена киселина, която лесно се окислява до въглероден диоксид и вода:

б) Ако в молекулата на алкена въглеродният атом при двойната връзка съдържа два въглеродни заместителя (например в молекулата на 2-метилбутен-2), тогава по време на неговото окисление се образува кетон, тъй като превръщането на такъв атом в атом на карбоксилна група е невъзможно без разрушаване на връзката С–С, която е относително стабилна при тези условия:

в) Ако молекулата на алкена е симетрична и двойната връзка се съдържа в средата на молекулата, тогава по време на окислението се образува само една киселина:

Характеристика на окисляването на алкените, при което въглеродните атоми при двойната връзка съдържат два въглеродни радикала, е образуването на два кетона:


2. В неутрална или леко алкална среда окислението се придружава от образуването на диоли (двувалентни алкохоли) и хидроксилните групи се добавят към тези въглеродни атоми, между които има двойна връзка:

По време на тази реакция виолетовият цвят на водния разтвор на KMnO 4 се обезцветява.Затова се използва като качествена реакция към алкени (реакция на Вагнер).
3. Окисляването на алкени в присъствието на паладиеви соли (процес на Wacker) води до образуването алдехиди и кетони:
2CH2 =CH2 + O2 PdCl2/H2O→ 2 CH 3 -CO-H
Хомолозите се окисляват при по-малко хидрогенирания въглероден атом:
CH3-CH2-CH=CH2 + 1/2O2 PdCl2/H2O→ CH 3 - CH 2 -CO-CH 3
Алкини
Окислението на ацетилена и неговите хомолози протича в зависимост от средата, в която протича процесът.
а) В кисела среда процесът на окисление се придружава от образуването на карбоксилни киселини:

Реакцията се използва за определяне на структурата на алкините въз основа на техните окислителни продукти:

В неутрална и леко алкална среда окислението на ацетилена се придружава от образуването на съответните оксалати (соли на оксаловата киселина), а окисляването на хомолозите се придружава от разкъсване на тройната връзка и образуване на соли на карбоксилна киселина:

За ацетилен:
1) В кисела среда:
H-C≡C-H KMnO 4, з 2 ТАКА 4 → HOOC-COOH (оксалова киселина)
3CH≡CH +8KMnO 4 з 2 О→ 3KOOC-ГОТВАЙ калиев оксалат+8MnO 2 ↓+ 2KOH+ 2H 2 O
Арени
(бензен и неговите хомолози)
Когато арените се окисляват в кисела среда, трябва да се очаква образуването на киселини, а в алкална среда - соли.
Бензоловите хомолози с една странична верига (независимо от нейната дължина) се окисляват от силен окислител до бензоена киселина при α-въглеродния атом. При нагряване бензеновите хомолози се окисляват от калиев перманганат в неутрална среда, за да образуват калиеви соли на ароматни киселини.
5C 6 H 5 –CH 3 + 6KMnO 4 + 9H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O,
5C 6 H 5 –C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 = 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O,
C 6 H 5 –CH 3 + 2KMnO 4 = C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O.
Подчертаваме, че ако има няколко странични вериги в една молекула на арен, тогава в кисела среда всяка от тях се окислява при a-въглеродния атом до карбоксилна група, което води до образуването на многоосновни ароматни киселини:

1) В кисела среда:
C6H5-CH2-R KMnO 4, з 2 ТАКА 4 → C 6 H 5 -COOH бензоена киселина+CO2
2) В неутрално или алкална среда:
C6H5-CH2-R KMnO4, H2O/(OH)→ C 6 H 5 -COOK + CO 2
3) Окисляване на бензенови хомолози с калиев перманганат или калиев дихромат при нагряване:
C6H5-CH2-R KMnO 4, з 2 ТАКА 4, T ˚ ° С→ C 6 H 5 -COOH бензоена киселина+ R-COOH
4) Окисляване на кумол с кислород в присъствието на катализатор (кумол метод за производство на фенол):
C6H5CH(CH3)2 O2, H2SO4→C6H5-OH фенол + CH3 -CO-CH3 ацетон
5C 6 H 5 CH(CH 3) 2 + 18KMnO 4 + 27H 2 SO 4 → 5C 6 H 5 COOH + 42H 2 O + 18MnSO 4 + 10CO 2 + K 2 SO 4
C 6 H 5 CH(CH 3) 2 + 6H 2 O – 18ē→ C 6 H 5 COOH + 2CO 2 + 18H + | х 5
MnO 4 - + 8H + + 5ē→ Mn +2 + 4H 2 O | х 18
Моля обърнете вниманиече когато леко окислениестирен с калиев перманганат KMnO 4 в неутрална или леко алкална средаπ връзката се разкъсва и се образува гликол (двувалентен алкохол). В резултат на реакцията оцветеният разтвор на калиев перманганат бързо се обезцветява и се утаява кафява утайка от манганов (IV) оксид.
Окисляване силен окислител– калиев перманганат в кисела среда – води до пълно разкъсване на двойната връзка и образуване на въглероден диоксид и бензоена киселина и разтворът се обезцветява.
C 6 H 5 −CH═CH 2 + 2 KMnO 4 + 3 H 2 SO 4 → C 6 H 5 −COOH + CO 2 + K 2 SO 4 + 2 MnSO 4 +4 H 2 O
алкохоли
Трябва да се помни, че:
1) първичните алкохоли се окисляват до алдехиди:
3CH 3 –CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O;
2) вторичните алкохоли се окисляват до кетони:

3) реакцията на окисление не е типична за третичните алкохоли.
Третичните алкохоли, в молекулите на които няма водороден атом при въглеродния атом, съдържащ ОН групата, не се окисляват при нормални условия. При тежки условия (под въздействието на силни окислители и когато високи температури) те могат да бъдат окислени до смес от карбоксилни киселини с ниско молекулно тегло, т.е. настъпва разрушаване на въглеродния скелет.
Когато метанолът се окислява с подкислен разтвор на калиев перманганат или калиев дихромат, се образува CO 2 .
Първичните алкохоли по време на окисление, в зависимост от условията на реакцията, могат да образуват не само алдехиди, но и киселини.
Например, окисляването на етанол с калиев дихромат на студено завършва с образуването на оцетна киселина, а при нагряване - ацеталдехид:
3CH 3 –CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 = 3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O,
Ако три или повече ОН групи са свързани към съседни въглеродни атоми, тогава при окисляване с периодна киселина средните или средните атоми се превръщат в мравчена киселина
Окисляването на гликоли с калиев перманганат в кисела среда е подобно на окислителното разцепване на алкени и също води до образуването на киселини или кетони, в зависимост от структурата на първоначалния гликол.
Алдехиди и кетони
Алдехидите се окисляват по-лесно от алкохолите в съответните карбоксилни киселини не само под въздействието на силни окислители (кислород от въздуха, подкиселени разтвори на KMnO 4 и K 2 Cr 2 O 7), но и под въздействието на слаби (разтвор на амоняк на сребърен оксид или меден (II) хидроксид):
5CH 3 –CHO + 2KMnO 4 + 3H 2 SO 4 = 5CH 3 –COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O,
3CH 3 –CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –COOH + Cr 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
CH 3 –CHO + 2OH CH 3 –COONH 4 + 2Ag + 3NH 3 + H 2 O
Специално внимание!!! Окисляването на метанал с амонячен разтвор на сребърен оксид води до образуването на амониев карбонат, а не на мравчена киселина:
HCHОТНОСНО+ 4OH = (NH 4) 2 CO 3 + 4Ag + 6NH 3 + 2H 2 O.
За съставяне на уравнения за редокс реакции се използват както методът на електронния баланс, така и методът на полуреакция (електронно-йонен метод).
За органичната химия не е важно степента на окисление на атома, а промяната в електронната плътност, в резултат на което върху атомите се появяват частични заряди, които по никакъв начин не съответстват на стойностите на степента на окисление.
Много университети включват в билетите за приемни изпити задачи за избор на коефициенти в уравненията на OVR с помощта на йонно-електронен метод (метод на полуреакция). Ако поне малко се обръща внимание на този метод в училище, то е главно за окисляването на неорганични вещества.
Нека се опитаме да използваме метода на полуреакция за окисление на захароза с калиев перманганат в кисела среда.
Предимството на този метод е, че не е необходимо веднага да гадаете и записвате продуктите на реакцията. Те се определят доста лесно от уравнението. Окислителят в кисела среда най-пълно проявява своите окислителни свойства, например анионът MnO - се превръща в катион Mn 2+, лесно окисляващите се органични съединения се окисляват до CO 2.
Нека запишем трансформациите на захарозата в молекулярна форма:
![]()
От лявата страна липсват 13 кислородни атома; елиминираме това противоречие, добавяме 13 молекули Н2О.
Лявата страна вече съдържа 48 водородни атома, те се освобождават под формата на Н + катиони:
Сега нека изравним общите такси отдясно и отляво:
Схемата на полуреакция е готова. Изготвянето на диаграма на втората полуреакция обикновено не създава затруднения:
Нека комбинираме двете схеми:
![]()
Задание за самостоятелна работа:
Попълнете CRM и подредете коефициентите, като използвате метода на електронния баланс или метода на полуреакция:
CH 3 -CH=CH-CH 3 + KMnO 4 + H 2 SO 4 →
CH3-CH=CH-CH3 + KMnO4 + H2ОТНОСНО →
(CH 3) 2 C=C-CH 3 + KMnO 4 + H 2 SO 4 →
CH 3 -CH 2 -CH=CH 2 + KMnO 4 + H 2 SO 4 →
СЪСH 3 -CH 2 -C≡C-CH 3 + KMnO 4 + H 2 SO 4 →
C 6 H 5 -CH 3 + KMnO 4 + H2O →
C 6 H 5 -C 2 H 5 + KMnO 4 + H 2 SO 4 →
° С 6 з 5 - CH 3 + KMnO 4 + з 2 ТАКА 4 →
Моите бележки:
Студентите трябва да обърнат специално внимание на поведението на окислителя - калиев перманганат KMnO 4 в различни среди. Това се дължи на факта, че окислително-редукционните реакции в CMM се случват не само в задачи C1 и C2. В задачите на SZ, представляващи верига от трансформации на органични вещества, окислително-редукционните уравнения не са необичайни. В училище окислителят често се изписва над стрелката като [O]. Изискване за изпълнение на такива задачи на Единния държавен изпит е задължителното обозначаване на всички изходни вещества и реакционни продукти с подреждането на необходимите коефициенти.



