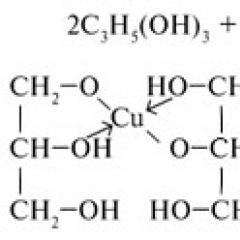
Хидролиза на меден (II) хлорид. Хидролиза на меден (II) хлорид меден хлорид: поведение в околната среда
Обща информация за хидролизата на меден (II) хлорид
ОПРЕДЕЛЕНИЕ
Меден (II) хлорид - средна сол, образувана от слаба основа - меден (II) хидроксид (Cu (OH) 2) и силна киселина - солна (солна) (HCl). Формула - CuCl 2.
Представлява кристали с жълто-кафяв (тъмнокафяв) цвят; под формата на кристални хидрати - зелено. Моларната маса е 134 g / mol.
Фигура: 1. Меден хлорид (II). Външен вид.
Хидролиза на меден (II) хлорид
Хидролизира се от катион. Природата на околната среда е кисела. Теоретично е възможен втори етап. Уравнението на хидролизата е както следва:
Първи етап:
CuCl 2 ↔ Cu 2+ + 2Cl - (дисоциация на солта);
Cu 2+ + HOH ↔ CuOH + + H + (катионна хидролиза);
Cu 2+ + 2Cl - + HOH ↔ CuOH + + 2Cl - + H + (йонно уравнение);
CuCl2 + H2O ↔ Cu (OH) Cl + HCl (молекулно уравнение).
Втори етап:
Cu (OH) Cl ↔ CuOH + + Cl - (дисоциация на солта);
CuOH + + HOH ↔ Cu (OH) 2 ↓ + H + (катионна хидролиза);
CuOH + + Cl - + HOH ↔ Cu (OH) 2 ↓ + Cl - + H + (йонно уравнение);
Cu (OH) Cl + H 2 O ↔ Cu (OH) 2 ↓ + HCl (молекулно уравнение).
Примери за решаване на проблеми
ПРИМЕР 1
ПРИМЕР 2
| Задачата | Запишете уравнението за електролиза за разтвор на меден (II) хлорид. Каква маса вещество ще се отдели на катода, ако 5 g меден (II) хлорид се подложи на електролиза? |
| Решение | Нека напишем уравнението за дисоциацията на меден (II) хлорид във воден разтвор: CuCl 2 ↔ Cu 2+ + 2Cl -. Нека запишем условно схемата за електролиза: (-) Катод: Cu 2+, H 2 O. (+) Анод: Cl -, H 2 O. Cu 2+ + 2e → Cu o; 2Cl - -2e → Cl 2. Тогава уравнението за електролиза за воден разтвор на меден (II) хлорид ще изглежда така: CuCl2 \u003d Cu + Cl2. Изчисляваме количеството вещество меден (II) хлорид, като използваме данните, посочени в декларацията за проблема (моларна маса - 134 g / mol): υ (CuCl2) \u003d m (CuCl2) / M (CuCl2) \u003d 5/134 \u003d 0,04 mol. Според реакционното уравнение υ (CuCl2) \u003d υ (Cu) \u003d 0,04 mol. След това изчисляваме масата на медта, отделена на катода (моларна маса - 64 g / mol): m (Cu) \u003d υ (Cu) × M (Cu) \u003d 0,04 × 64 \u003d 2,56 g. |
| Отговор | Масата на медта, отделена на катода, е 2,56 g. |
Основна информация:
| Защитни, инхибиращи спори на гъбички и патогени от навлизането на водещи тъкани |
| Corona corpus luteum (безводен) до синьо-зелени кристали (дихидрат) |
Издание:
меден хлорид: поведение в околната среда
| Индекс | Стойност | Обяснение | ||
| Разтворимост във вода при 20 o C (mg / l) | 757000 Q4 Висока||||
| Разтворимост в органични разтворители при 20 o C (mg / l) | 680000 Q4 - метанол -||||
| Точка на топене (o C) | - - -||||
| Температура на изпаряване (o C) | - - -||||
| Температура на разлагане (o C) | - - -||||
| Точка на възпламеняване (o C) | - - -||||
| Коефициент на разпределение в системата октанол / вода при pH 7, 20 o C | P: - - -||||
| Специфично тегло (g / ml) / Специфично тегло | 3.39 Q3 -||||
| Константа на дисоциация (pKa) при 25 o C | - - -||||
| Забележка: | ||||
| Налягане на парите при 25 o C (MPa) | 1,00 X 10 -10 Q1 Нелетлив||||
| Законна константа на Хенри при 25 o C (Pa * m 3 / mol) | - - -||||
| Константа на закона на Хенри при 20 o C (безразмерна) | 7,29 X 10 -21 Изчислено Не е летливо||||
| Период на гниене в почвата (дни) | DT50 (типичен) - - -||||
| - | ||||
| DT50 фотолиза на вода (дни) при pH 7 | Стойност: - - -||||
| - | ||||
| Водна хидролиза на DT50 (дни) при 20 o C и рН 7 | Стойност: - - -||||
| - | ||||
| DT50 отлагане на вода (дни) | - - -||||
| Само водна фаза DT50 (дни) | - - -||||
| Потенциален индекс на измиване GUS | - - -||||
| Индекс на растеж на концентрацията на SCI в подпочвените води (μg / l) при внасяне от 1 kg / ha (l / ha) | Стойност: - - -||||
| - | ||||
| Потенциал за индекс на транспорт на частици | - - -||||
| Koc - коефициент на разпределение на органичния въглерод (ml / g) | - - -||||
| рН стабилност: | ||||
| Забележка: | ||||
| Изотерма на адсорбцията на Freundlich | Kf: -- | -|||
| - | ||||
| Максимално поглъщане на UV (l / (mol * cm)) | - - -||||
меден хлорид: екотоксичност
| Индекс | Стойност | Източник / Качествени показатели / Друга информация | Обяснение | |
| Фактор на биоконцентрация | BCF: -- | -|||
| Потенциал за биоакумулиране | - - -||||
| LD50 (mg / kg) | 140 V3 Плъх Умерен||||
| Бозайници - Храна за кратък период NOEL | (mg / kg): -- | -|||
| Птици - остра LD50 (mg / kg) | - - -||||
| Птици - Остра токсичност (CK50 / LD50) | - - -||||
| Риба - остри 96 часа CK50 (mg / l) | 0,24 F4 Дъгова пъстърва Умерено||||
| Риба - хронична 21 дни NOEC (mg / L) | - - -||||
| Водни безгръбначни - остри 48 часа EC50 (mg / L) | - - -||||
| Водни безгръбначни - хронични 21 дни NOEC (mg / L) | - - -||||
| Водни ракообразни - остри 96h CK50 (mg / L) | 0,134 F3 Скариди-мисида Умерено||||
| Долни микроорганизми - остри 96 часа CK50 (mg / l) | 0,043 F4 Комар-хироном Висок||||
| NOEC, статичен, вода (mg / l) | - - -||||
| Долни микроорганизми - хроничен 28-дневен NOEC, седиментна скала (mg / kg) | - - -||||
| Водни растения - Остри 7 дни EC50, биомаса (mg / l) | - - -||||
| Водорасли - остър 72-часов EC50, растеж (mg / l) | 0,55 H1 Неизвестни видове Умерено||||
| Водорасли - Хроничен 96-часов растеж на NOEC (mg / l) | - - -||||
| Пчели - остър 48-часов LD50 (μg / проба) | - - -||||
| Почвени червеи - остър 14-дневен CK50 (mg / kg) | - - -||||
| Почвени червеи - хронична 14-дневна максимална концентрация на неактивни вещества, размножаване (mg / kg) | 15 A4 Земния червей, като Cu, 8 седмица Умерено||||
| Други членестоноги (1) | LR50 (g / ha): - - -||||
| Други членестоноги (2) | LR50 (g / ha): - - -||||
| Почвени микроорганизми | - - -||||
| Налични данни за мезосвета (мезокосмос) | NOEAEC mg / l: - - -||||
меден хлорид: човешко здраве
Основни показатели:
| Индекс | Стойност | Източник / Качествени показатели / Друга информация | Обяснение | |
| Бозайници - остър орален LD50 (mg / kg) | 140 V3 Плъх Умерен||||
| Бозайници - дермална LD50 (mg / kg телесна маса) | - - -||||
| Бозайници - Вдишване | ||||
§ един. Химични свойства на просто вещество (ст. Прибл. \u003d 0).
а) Връзка с кислорода.
За разлика от съседите си от подгрупата - среброто и златото - медта реагира директно с кислорода. Медта проявява незначителна активност към кислорода, но във влажен въздух постепенно се окислява и се покрива със зеленикав филм, състоящ се от основни медни карбонати:
В сух въздух окисляването протича много бавно, най-тънкият слой меден оксид се образува на медната повърхност:
Външно медта не се променя едновременно, тъй като медният (I) оксид, подобно на самата мед, е с розов цвят. Освен това оксидният слой е толкова тънък, че пропуска светлина, т.е. прозира. По различен начин медта се окислява при нагряване, например при 600-800 0 С. През първите секунди окислението преминава към меден (I) оксид, който от повърхността се превръща в черен меден (II) оксид. Образува се двуслойно оксидно покритие.
Формация Q (Cu 2 O) \u003d 84935 kJ.

Фигура 2. Структура на меден оксиден филм.
б) Взаимодействие с вода.
Метали от медната подгрупа са в края на електрохимичната серия от напрежения, след водородния йон. Следователно тези метали не могат да изместят водорода от водата. В същото време водородът и други метали могат да изместят металите от медната подгрупа от разтвори на техните соли, например:
Тази реакция е окислително-редукционна, тъй като настъпва преходът на електрони:
Молекулярният водород измества с голяма трудност металите от медната подгрупа. Това се обяснява с факта, че връзката между водородните атоми е силна и много енергия се изразходва за нейното разрушаване. Реакцията протича само с водородни атоми.
При липса на кислород медта практически не взаимодейства с водата. В присъствието на кислород медта бавно реагира с вода и се покрива със зелен филм от меден хидроксид и основен карбонат:
в) Взаимодействие с киселини.
Попадайки в поредицата от напрежения след водорода, медта не я измества от киселините. Следователно солната и разредената сярна киселина не влияе върху медта.
Въпреки това, в присъствието на кислород, медта се разтваря в тези киселини с образуването на съответните соли:
Единственото изключение е йодноводородната киселина, която реагира с мед, за да освободи водород и образува много стабилен меден (I) комплекс:
2 Cu + 3 Здравей → 2 З.[ CuI 2 ] + З. 2
Медта реагира и с киселини - окислители, например с азотна киселина:
Cu + 4HNO 3( край .) → Cu (NO 3 ) 2 + 2NO 2 + 2Н 2 О
3Cu + 8HNO 3( разреден .) → 3Cu (НЕ 3 ) 2 + 2NO + 4H 2 О
А също и с концентрирана студена сярна киселина:
Cu + H 2 ТАКА 4 (конц.) → CuO + SO 2 + Н 2 О
С гореща концентрирана сярна киселина :
Cu + 2H 2 ТАКА 4( край ., горещо ) → CuSO 4 + ТАКА 2 + 2Н 2 О
С безводна сярна киселина при температура от 200 ° C се образува меден (I) сулфат:
2Cu + 2H 2 ТАКА 4( безводни .) 200 ° С → Cu 2 ТАКА 4 ↓ + SO 2 + 2Н 2 О
г) Връзка с халогени и някои други неметали.
Q образуване (CuCl) \u003d 134300 kJ
Q образуване (CuCl2) \u003d 111700 kJ
Медта реагира добре с халогени, дава два вида халогениди: CuX и CuX 2 .. Под действието на халогени при стайна температура не се наблюдават видими промени, но на повърхността първо се образува слой адсорбирани молекули, а след това и най-тънкият слой халогениди. При нагряване реакцията с мед е много бурна. Загряваме медна жица или фолио и я спускаме гореща в буркан с хлор - в близост до медта ще се появят кафяви пари, състоящи се от меден (II) хлорид CuCl 2 с примес на меден (I) хлорид CuCl. Реакцията протича спонтанно поради отделената топлина. Едновалентните медни халогениди се получават чрез взаимодействие на метална мед с разтвор на двувалентен меден халогенид, например:
В този случай монохлоридът изпада от разтвора като бяла утайка върху медната повърхност.
Медта също така лесно влиза в реакция със сяра и селен при нагряване (300-400 ° C):
2Cu + S → Cu 2 С
2Cu + Se → Cu 2 Se
Но медта не реагира с водород, въглерод и азот дори при високи температури.
д) Взаимодействие с неметални оксиди
При нагряване медта може да измести прости вещества от някои оксиди на неметали (например серен (IV) оксид и азотни оксиди (II, IV)), като по този начин образува термодинамично по-стабилен меден (II) оксид:
4Cu + SO 2 600-800 ° С → 2CuO + Cu 2 С
4Cu + 2NO 2 500-600 ° С → 4CuO + N 2
2 Cu+2 НЕ 500-600 ° ° С →2 CuO + н 2
§2. Химични свойства на медна мед (st.ok. \u003d +1)
Във водните разтвори Cu + йонът е много нестабилен и непропорционален:
Cu + ↔ Cu 0 + Cu 2+
Въпреки това, медта в окислително състояние (+1) може да бъде стабилизирана в съединения с много ниска разтворимост или чрез комплексообразуване.
а) Меден оксид (Аз) Cu 2 О
Амфотерен оксид. Кристалното вещество е кафеникаво-червено. Той се среща естествено под формата на минерала куприт. Може да се получи изкуствено чрез нагряване на разтвор на медна (II) сол с алкал и някакъв силен редуциращ агент, например формалин или глюкоза. Медният (I) оксид не реагира с водата. Медният (I) оксид се прехвърля в разтвор с концентрирана солна киселина, за да се образува хлориден комплекс:
Cu 2 О+4 HCI→2 З.[ CuCl2]+ З. 2 О
Също така ще разтворим в концентриран разтвор на амоняк и амониеви соли:
Cu 2 O + 2NH 4 + →2 +
В разредената сярна киселина тя се пропорционализира на двувалентна мед и метална мед:
Cu 2 O + H 2 ТАКА 4 (разреден) → CuSO 4 + Cu 0 ↓ + H 2 О
Също така, меден (I) оксид влиза във следните реакции във водни разтвори:
1. Бавно окислени с кислород до меден (II) хидроксид:
2 Cu 2 О+4 З. 2 О+ О 2 →4 Cu(ОХ) 2 ↓
2. Реагира с разредени хидрохалогенни киселини, за да образува съответните медни (I) халогениди:
Cu 2 О+2 З.G → 2CuG ↓ +З. 2 О (G \u003dCl, Br, J)
3. Възстановен до метална мед чрез типични редуктори, например натриев хидросулфит в концентриран разтвор:
2 Cu 2 О+2 NaSO 3 →4 Cu↓+ Na 2 ТАКА 4 + З. 2 ТАКА 4
Медният (I) оксид се редуцира до метална мед при следните реакции:
1. При нагряване до 1800 ° C (разлагане):
2 Cu 2 О - 1800 ° ° С →2 Cu + О 2
2. Когато се нагрява в поток от водород, въглероден окис, с алуминий и други типични редуциращи агенти:
Cu 2 O + H 2 - \u003e 250 ° С → 2Cu + H 2 О
Cu 2 O + CO - 250-300 ° С → 2Cu + CO 2
3 Cu 2 О + 2 Ал - 1000 ° ° С →6 Cu + Ал 2 О 3
Също така при високи температури медният (I) оксид реагира:
1. С амоняк (образува се меден (I) нитрид)
3 Cu 2 О + 2 NH 3 - 250 ° ° С →2 Cu 3 н + 3 З. 2 О
2. С оксиди на алкални метали:
Cu 2 O + M 2 O- 600-800 ° С →2 МCuO (M \u003d Li, Na, K)
В този случай се образуват медни купрати (I).
Медният (I) оксид реагира значително с основи:
Cu 2 О+2 NaOH (конц.) + З. 2 О↔2 Na[ Cu(ОХ) 2 ]
б) Меден хидроксид (Аз) CuOH
Медният (I) хидроксид образува жълто вещество, не се разтваря във вода.
Лесно се разлага при нагряване или варене:
2 CuOH → Cu 2 О + З. 2 О
в) халогенидиCuF, CuОТл, CuBr иCuJ
Всички тези съединения са бели кристални вещества, които са слабо разтворими във вода, но са лесно разтворими в излишък на NH 3, цианидни йони, тиосулфатни йони и други силни комплексиращи агенти. Йодът образува само съединението Cu +1 J. В газообразно състояние се образуват цикли от типа (CuH) 3. Обратимо разтворим в съответните хидрохалогенни киселини:
CuG + HG ↔З.[ Cuд 2 ] (Г \u003dCl, Br, J)
Хлоридът и бромидът на медта (I) са нестабилни във влажен въздух и постепенно се превръщат в основни медни (II) соли:
4 CuG +2З. 2 О + О 2 →4 Cu(ОХ) Г (Г \u003d Cl, Br)
г) Други медни съединения (Аз)
1. Меден (I) ацетат (СН 3 СООСu) - медно съединение, има формата на безцветни кристали. Във вода той бавно се хидролизира до Cu 2 O; във въздуха се окислява до двувалентен меден ацетат; CH 3 COOCu се получава чрез редукция на (CH 3 COO) 2 Cu с водород или мед, чрез сублимация (CH 3 COO) 2 Cu във вакуум или чрез взаимодействие на (NH 3 OH) SO 4 с (CH 3 COO) 2 Cu в разтвор в присъствието на H 3 COONH 3. Веществото е токсично.
2. Меден (I) ацетиленид - червено-кафяви, понякога черни кристали. В суха форма кристалите детонират при удар или нагряване. Стабилен, когато е мокър. Детонацията при липса на кислород не генерира газообразни вещества. Разлага се под действието на киселини. Образува се като утайка при преминаване на ацетилен в амонячни разтвори на медни (I) соли:
ОТ 2 З. 2 +2[ Cu(NH 3 ) 2 ](ОХ) → Cu 2 ° С 2 ↓ +2 З. 2 О+2 NH 3
Тази реакция се използва за качествено откриване на ацетилен.
3. Меден нитрид - неорганично съединение с формула Cu 3 N, тъмнозелени кристали.
Разлага се при отопление:
2 Cu 3 н - 300 ° ° С →6 Cu + н 2
Реагира бурно с киселини:
2 Cu 3 н +6 HCI - 300 ° ° С →3 Cu↓ +3 CuCl 2 +2 NH 3
§3. Химични свойства на двувалентната мед (st.ok. \u003d +2)
Най-стабилното окислително състояние на медта и най-характерното за нея.
а) Меден оксид (II) CuO
CuO е основният двувалентен меден оксид. Кристалите са черни на цвят, доста стабилни при нормални условия, практически неразтворими във вода. Среща се естествено под формата на минерал от черен тенорит (мелаконит). Медният (II) оксид реагира с киселини, образувайки съответните медни (II) и водни соли:
CuO + 2 HNO 3 → Cu(НЕ 3 ) 2 + З. 2 О
При сливане на CuO с основи се образуват медни (II) купрати:
CuO+2 KOH- т ° → К 2 CuO 2 + З. 2 О
При нагряване до 1100 ° C се разлага:
4CuO- т ° →2 Cu 2 О + О 2
б) Меден (II) хидроксидCu(ОХ) 2
Медният (II) хидроксид е синьо аморфно или кристално вещество, практически неразтворимо във вода. При нагряване до 70-90 ° C прахът Cu (OH) 2 или неговите водни суспензии се разлагат до CuO и H 2 O:
Cu(ОХ) 2 → CuO + З. 2 О
Това е амфотерен хидроксид. Реагира с киселини, образувайки вода и съответната медна сол:
Той не реагира с разредени разтвори на основи, в концентрирани разтвори се разтваря, образувайки яркосини тетрахидроксокупрати (II):
Медният (II) хидроксид образува основни соли със слаби киселини. Той се разтваря много лесно в излишък от амоняк, образувайки меден амоняк:
Cu (OH) 2 + 4NH 4 OH → (OH) 2 + 4Н 2 О
Медният амоняк има интензивен синьо-виолетов цвят, поради което се използва в аналитичната химия за определяне на малки количества Cu 2+ йони в разтвор.
в) Медни соли (II)
Простите медни (II) соли са известни за повечето аниони, с изключение на цианид и йодид, които при взаимодействие с катиона Cu 2+ образуват ковалентни медни (I) съединения, неразтворими във вода.
Медните соли (+2) са предимно водоразтворими. Синият цвят на техните разтвори е свързан с образуването на 2+ йон. Те често кристализират като хидрати. И така, от воден разтвор на меден (II) хлорид под 15 ° C тетрахидратът кристализира, при 15-26 ° C - трихидрат, над 26 ° C - дихидрат. Във водните разтвори медните (II) соли са леко хидролизирани и от тях често се утаяват базови соли.
1. Меден (II) сулфат пентахидрат (меден сулфат)
CuSO 4 * 5H 2 O, наречен меден сулфат, е от най-голямо практическо значение. Сухата сол има син цвят, но при леко нагряване (200 0 С) тя губи кристализационна вода. Безводна бяла сол. При по-нататъшно нагряване до 700 0 С, той се превръща в меден оксид, губещ серен триоксид:
CuSO 4 -- т ° → CuO+ ТАКА 3
Медният сулфат се приготвя чрез разтваряне на медта в концентрирана сярна киселина. Тази реакция е описана в раздела "Химични свойства на просто вещество". Медният сулфат се използва в електролитното производство на мед, в селското стопанство за борба с вредители и болести по растенията, за получаване на други медни съединения.
2. Меден (II) хлорид дихидрат.
Това са тъмнозелени кристали, лесно разтворими във вода. Концентрираните разтвори на меден хлорид са зелени, а разредените разтвори са сини. Това се дължи на образуването на комплекс от зелен хлорид:
Cu 2+ +4 Cl - →[ CuCl 4 ] 2-
И по-нататъшното му унищожаване и образуването на син аква комплекс.
3. Меден (II) нитрат трихидрат.
Кристално вещество със син цвят. Получава се чрез разтваряне на медта в азотна киселина. При нагряване кристалите първо губят вода, след това се разлагат с отделянето на кислород и азотен диоксид, превръщайки се в меден (II) оксид:
2Cu (NO 3 ) 2 -- t ° → 2CuO + 4NO 2 + O 2
4. Хидроксиран (II) карбонат.
Медните карбонати са нестабилни и почти никога не се използват на практика. От известно значение за производството на мед е само основният меден карбонат Cu 2 (OH) 2 CO 3, който се среща в природата под формата на минерала малахит. При нагряване той лесно се разлага с отделянето на вода, въглероден оксид (IV) и меден (II) оксид:
Cu 2 (ОН) 2 CO 3 -- t ° → 2CuO + H 2 O + CO 2
§4. Химични свойства на тривалентната мед (st.ok. \u003d +3)
Това състояние на окисление е най-малко стабилно за медта и следователно съединенията на медта (III) са по-скоро изключения, отколкото "правила". Съществуват обаче някои тривалентни медни съединения.
а) Меден (III) оксид Cu 2 О 3
Това е кристално вещество, тъмно гранатов цвят. Не се разтваря във вода.
Получава се чрез окисляване на меден (II) хидроксид с калиев пероксодисулфат в алкална среда при отрицателни температури:
2Cu (OH) 2 + K 2 С 2 О 8 + 2KOH - -20 ° С → Cu 2 О 3 ↓ + 2K 2 ТАКА 4 + 3Н 2 О
Това вещество се разлага при температура 400 0 С:
Cu 2 О 3 -- т ° →2 CuO+ О 2
Медният (III) оксид е силно окислително средство. При взаимодействие с хлороводород хлорът се редуцира до свободен хлор:
Cu 2 О 3 +6 HCI-- т ° →2 CuCl 2 + Cl 2 +3 З. 2 О
б) Купрати от мед (III)
Това са черни или сини вещества, нестабилни във вода, диамагнитни, анион - ленти на квадрати (dsp 2). Образувано от взаимодействието на меден (II) хидроксид и алкален метален хипохлорит в алкална среда:
2 Cu(ОХ) 2 + МClO + 2 NaOH→ 2MCuO 3 + NaCl +3 З. 2 О (М= Na- Cs)
в) калиев хексафлуорокупрат (III)
Зелено вещество, парамагнитно. Октаедрична структура sp 3 d 2. Меден флуориден комплекс CuF 3, който се разлага в свободно състояние при -60 0 С. Образува се чрез нагряване на смес от калиев и меден хлориди във флуорна атмосфера:
3KCl + CuCl + 3F 2 → K 3 + 2Cl 2
Разлага водата, образувайки свободен флуор.
§5. Медни съединения в степен на окисление (+4)
Досега науката познава само едно вещество, където медта е в +4 степен на окисление, това е цезиев хексафлуорокупрат (IV) - Cs 2 Cu +4 F 6 - оранжево кристално вещество, стабилно в стъклени ампули при 0 0 C. Реагира бурно с вода. Получава се чрез флуориране при високо налягане и температура на смес от цезиеви и медни хлориди:
CuCl 2 + 2CsCl + 3F 2 -- т ° п → Cs 2 CuF 6 + 2Cl 2