الأكسدة الصلبة للأكمين في بيئة قلوية. ردود الفعل الأكسدة العضوية
كما ذكرنا بالفعل، فإن أكسدة المادة العضوية هو إدخال الأكسجين في تكوينه و (أو) انقسام الهيدروجين. عملية الانتعاش - عكس (حقن الانقسام الهيدروجين والأكسجين). بالنظر إلى تكوين الغنانيين (CNH2N + 2)، يمكن أن نستنتج عن عدم قدرتها على الانضمام إلى رد فعل الاسترداد، ولكن القدرة على المشاركة في ردود الفعل الأكسدة.
Alkaans - مركبات ذات درجات منخفضة من أكسدة الكربون، وهذا يتوقف على ظروف التفاعل، يمكن أن تتأكسد مع تكوين اتصالات مختلفة.
في درجة الحرارة العادية، لا تتفاعل الألكان حتى مع عوامل مؤكسدة قوية (H2CR2O7، KMNO4، إلخ). عند تقديمه في الشعلة المفتوحة، يحترق الكانا. في هذه الحالة، في الفائض من الأكسجين، يحدث الأكسدة الكاملة الخاصة بهم إلى CO2، حيث يحتوي الكربون على أعلى درجة من الأكسدة +4 والماء. يؤدي حرق الهيدروكربونات إلى تمزق جميع روابط جميع اتصالات C-C و C-H ويرافقه إصدار كمية كبيرة من الحرارة (رد فعل مخلل).
من المقبول عموما أن آلية الأكسدة الكنانية تتضمن عملية سلسلة جذرية، نظرا لأن الأكسجين نفسه مجنون من أجل تمزيق ذرة الهيدروجين من الكان، هناك حاجة إلى جسيم، مما سيبدأ حدوث حدوث جذرية ألكيل مع الأكسجين، إعطاء بيروكسيا. ثم قد يمزح بيروكسلايديكال ذرة الهيدروجين من جزيء آخر من جزيء آخر لتشكيل أكسيد الألكيدروبير والراديكالي.

من الممكن تأكسد الألكان مع الأكسجين الجوي عند 100-150 درجة مئوية في وجود حافز - خلات المنجنيز، يتم تطبيق هذا التفاعل في الصناعة. يحدث الأكسدة عندما يتم تحويل تيار الهواء عبر البارافين الذائب الذي يحتوي على لحام المنغنيز.
لأن نتيجة لرد الفعل، يتم تشكيل مزيج من الأحماض، يتم فصلها عن البارافين غير المدعومة بحل في القلوي المائي، ثم تحييدها من قبل حمض المعدنية.
مباشرة في الصناعة، يتم استخدام هذه الطريقة للحصول على حمض الخليك من ح-بوتان:
أكسدة الكنز
تفاعلات الأكسدة الكينية مقسمة إلى مجموعتين: 1) ردود الفعل التي يتم فيها الحفاظ على الهيكل العظمي الكربوني، 2) من رد فعل التدمير التأكسدي من الهيكل العظمي الكربوني من جزيء السندات المزدوجة.
ردود الفعل الأكسدة للأكمين مع الحفاظ على هيكل عظمي من الكربون
1. الاغتصاب (رد فعل بويضات)
Acyclic Alkenes الدوري عند التفاعل مع المخاضرات في إبوكسيدات متوسطة غير قطبي (أوكسيران).
أيضا، يمكن الحصول على أوكسيرانات من خلال الأكمام الأكسدة عن طريق هيدروبوبروكسيدات في وجود المحفزات الموليبدينوم والتنجستن والفاناديوم

يتم الحصول على أبسط أوكسيران - أكسيد الإيثيلين - في الصناعة عن طريق الأكسجين بواسطة الأكسجين في وجود أكسيد الفضة أو الفضة كحافز.

2. مكافحة هيدروكسيل (التحلل المائي للإصابة)
تحلل الحمض (أو القلوية) يتحلل المائي في الإيبوكسيدات إلى إفصاح دورة أكسيد مع تكوين تحرينيين.

في المرحلة الأولى، يتم تبليغ Atom الأكسجين الإبوكسيد إلى تكوين كاتيشية أوكسونيوم دورية، والتي تم الكشف عنها نتيجة لهجوم نويفي من جزيء المياه.
يؤدي الكشف عن حلقة الايبوكسي التي يحفزها القاعدة أيضا إلى تكوين العابر الجليكول.

3. الخطيئة هيدروكسيل
واحدة من أقدم طرق الأكسدة للألكين هي رد فعل فاغنر (الأكسدة البوتاسيوم برمنانجانات). في البداية، يتكون الأكسدة من قبل إيكل دوري من حمض المنغنيز، الذي يتم تحريره إلى الاصلي

بالإضافة إلى رد فعل فاغنر هناك طريقة أخرى لرمز هيدروكسيات من ألكينز بموجب عمل أكسيد أسماوي (VIII)، الذي اقترحه خور. بموجب عمل طول الأبطال، يتم تشكيل عوزميوم على ألكين على الأثير أو الديوكساني سوداء مترسب من حمض OSMISIC Cyclic Ester - Osmat. ومع ذلك، فإن إضافة OSO4 إلى اتصالات متعددة تسارع بشكل ملحوظ في بيريدين. يسهل تحلل الترسب الأسود الناتج من أسمت بسهولة من خلال إجراء المحلول المائي لهيدروسلفيت الصوديوم:

Preshanganate Permanganate أو Osmia Oxide (VIII) أكسدة Alken إلى CIS-1،2-Diol.
تقسيم الأكسدة للأكمين
تشمل الانقسام المؤكسدي للأكمين ردود فعل التفاعل مع برمنجنات البوتاسيوم في القلوية أو في حمض الكبريتيك، وكذلك أكسدة حل ثالث أكسيد الكروم في حمض الخليك أو ديكروميت البوتاسيوم وحمض الكبريتيك. النتيجة النهائية لمثل هذه التحولات هي تقسيم هيكل عظمي الكربون في الرابطة المزدوجة وتشكيل أحماض الكربوكسيل أو الكيتونات.
يتم تقسيم ألكينز الأونحاد مع السندات المزدوجة الطرفية إلى حمض الكربوكسيل وثاني أكسيد الكربون:

إذا كانت كلا ذرات الكربون في سندات مزدوجة تشكل مجموعة ألكيل واحدة فقط، فسيتم تشكيل مزيج من أحماض Carboxymic:

ولكن إذا كان الاتصال Tetrazhesty-Dual هو Alken - كيتون:

تم تطوير رد فعل ألكينس الأوزون الأهمية الأكثر أهمية. لعدة عقود، شغل هذا التفاعل هو الطريقة الرئيسية لتحديد هيكل ألكين الأصلي. يتم تنفيذ هذا التفاعل من خلال تمرير حدودي حل الأوزون في حل الأكسجين ألكاني في كلوريد الميثيلين أو خلات الإيثيل في -80 ... -100 درجة مئوية يتم تعيين آلية هذا التفاعل على Cryga:


ozonides مركبات غير مستقرة تتحلل مع الانفجار. هناك طريقتان للتحلل من Ozonides - التأكسد والتقليل.
في التحلل المائي في Ozonides، يتم تقسيمها إلى مركبات الكربونيل بيروكسيد الهيدروجين. الأكسدة بيروكسيد الهيدروجين الأكسيد الألدهيد للأحماض الكربوكسيلية - وهذا هو تحلل مؤكسد:

تقليل تقسيم Ozonidov أكثر أهمية بكثير. تم العثور على ألدهيدس أو الكيتونات كمنتجات Ozonelysis اعتمادا على هيكل Alkene الأصلي:
بالإضافة إلى الأساليب المذكورة أعلاه، هناك طريقة أخرى مقترحة في عام 1955. Lemide:
في طريقة LIMYE، لا توجد إجراءات كثيفة العمالة لفصل ثاني أكسيد المنجنيز، لأن تتأكسد ثاني أكسيد والمنغانات مرة أخرى عن طريق الفوري إلى أيون برمنتجان. هذا يسمح لك باستخدام كمية الحفزية فقط من برمنجنات البوتاسيوم.
حدد سلسلة الكربون الرئيسية في الجزيء. أولا، يجب أن يكون أطول. ثانيا، إذا كان هناك سنتان أو أكثر من نفس السلاسل، فمن المحدد أكثر. على سبيل المثال، هناك سلاسل 2 في الجزيء بنفس الرقم (7) من الذرات C (أبرزها اللون):
في حالة (أ)، فإن السلسلة لديها 1 بديل، وفي (ب) - 2. لذلك، يجب عليك اختيار الخيار (ب).
1. إعادة توصيل ذرات الكربون في السلسلة الرئيسية بحيث الذرات مع بدائل مرتبطة بأرقام أصغر ربما. لذلك، يبدأ الترقيم بأقرب سلسلة إلى فرع. علي سبيل المثال:

قم بتسمية جميع المتطرفين (بدائل)، مما يدل على الأرقام المقبلة، مما يدل على موقعه في السلسلة الرئيسية. إذا كان هناك العديد من البدائل المتطابقة، فمنسب كل منها، يتم تسجيل الرقم (الموقع) من خلال الفاصلة، ويشار إلى رقمها من خلال لوحات المفاتيح. في-, ثلاثة-, تيترا-, بنتا- إلخ. (على سبيل المثال، 2،2 ثنائي ميثيل أو 2،3،3،5- تترامثيل).
ستكون أسماء جميع بدائل أبجديا (مثبتة من خلال أحدث قواعد جهودية).
اسم السلسلة الرئيسية من ذرات الكربون، أي كلkان العادي المناسب.
وهكذا، في عنوان القلق المتفرع، فإن جذر + لاحقة هو اسم Alkan العادي (اليونانية. الأرقام + ENFIX "ANFIX")، وأرقام - أرقام وأسماء المتطرفين الهيدروكربونات. مثال على بناء اسم:

كيم. alcanov sv.تكسير الألكان.التصحيح هو عملية التحلل الحراري للهيدروكربونات، التي تعتمد على تفاعل تقسيم سلسلة الكربون من الجزيئات الكبيرة لتشكيل اتصالات مع سلسلة أقصر. إيزووموث من القلكان يمكن تحويل أقلان الهيكل الطبيعي تحت تأثير المحفزات وعند تسخينها إلى أقلام متفرعة دون تغيير تكوين الجزيئات، أي. أدخل رد فعل Isomething. تشارك الألكان في هذه المقاطع، والتي لا تحتوي على أقل من 4 ذرات الكربون. على سبيل المثال، يحدث إبراز H-Pentan في ISOPENTANE (2-Methylbutane) عند 100 درجة مئوية في وجود محفز كلوريد الألومنيوم:
 تتمتع مواد البداية ونمن نتاج تفاعل إيزيوم نفس الصيغ الجزيئية وهي الأيزومرات الهيكلية (إيزوميريا الكربون الهيكلية).
تتمتع مواد البداية ونمن نتاج تفاعل إيزيوم نفس الصيغ الجزيئية وهي الأيزومرات الهيكلية (إيزوميريا الكربون الهيكلية).
الجذيف الكانوف
عندما تسخين الألكان في وجود محفزات (PT، PD، NI، FE، CR 2 O 3، FE 2 O 3، ZNO)، فهي حفزية الجفاف - انشقاق ذرات الهيدروجين بسبب تمزق روابط C --N.
يعتمد بنية منتجات الجفاف المنخفض على ظروف رد الفعل وطول السلسلة الرئيسية في جزيء ألكاني الأصلي.
1. منخفضة الألكانات التي تحتوي في سلاسل من 2 إلى 4 ذرات الكربون، مع التدفئة فوق محفز NI-Screenst، الهيدروجين المستنفد من المجاورة ذرات الكربون وتحول إلى alkenes.:
إلى جانب buten-2. في هذا التفاعل يتكون بوتين - 1. الفصل 2 \u003d Ch-CH 2 -CH 3. في وجود CR 2 O 3 / Al 2 O 3 Atalyst في 450-650 С ن.-بوتان أيضا تلقي butadiene-1،3.الفصل 2 \u003d Ch-Ch \u003d CH 2.
2. يتم استخدام ALKANS المحتوية في السلسلة الرئيسية أكثر من 4 ذرات الكربون للحصول عليها دوري روابط. يحدث في نفس الوقت إزالة الدسم - رد فعل إزالة الدماء، مما يؤدي إلى دائرة في دورة ثابتة.
إذا كانت السلسلة الرئيسية لجزيئات Alkane تحتوي على 5 (ولكن ليس أكثر) ذرات الكربون ( ن.- جاهز ومشتقات ألكيل)، ثم عند تسخينها فوق محفز PT، يتم تجميع ذرات الهيدروجين من ذرات المحطة الطرفية لسلسلة الكربون، ويتم تشكيل دورة من خمسة أعضاء (Cyclopentane أو مشتقاتها):

كما تدخل الألكانات مع السلسلة الرئيسية في 6 ذرات الكربون أيضا في تفاعل تنظيف الجثاء، لكنها تشكل دائما دورة من 6 أعضاء (Cyclohexane ومشتقاتها). بموجب شروط التفاعل، تعرض هذه الدورة لمزيد من الجفاف والمنعطف إلى دورة بنزول أكثر استقرارا حيويا من الهيدروكربون العطرية (Arena). علي سبيل المثال:

هذه ردود الفعل تكمن وراء العملية إصلاح - معالجة المنتجات البترولية من أجل الحصول على الساحة ( aromatization. الحد الهيدروكربونات) والهيدروجين. تحويل ن-القناانيين في الساحة يؤدي إلى تحسن في مقاومة التفجير للبنزين.
تعمل ألكنز مع السندات الثلاثية غير القلق بمثابة مصدر محتمل لتوليف 1،2 ديتونونات بموجب عمل وكيل مؤكسد مناسب. ومع ذلك، لم يكن هناك كاشف عالمي يسبب أكسدة سندات الكربون الكربون الثلاثي إلى 1،2-مجموعة Dicarbonyl. أكسيد RUO 4 - أكسيد الروثينيوم (الثامن) - باهظ الثمن للغاية وغالبا ما يؤدي إلى مزيد من التدمير التأكسدي من 1،2 ديكيتون للأحماض الكربوكسيلية. في تفاعل الأسيتيلينات التي تم تخفيفها مع عوامل مؤكسدة قوية، حيث يمكن إيقاف Permanganate البوتاسيوم، إلا في وسيلة محايدة تماما في درجة الحموضة 7-8 عند 0 درجة مئوية الأكسدة في مرحلة تشكيل -Diketon. على سبيل المثال، يتأكسد حمض الستائر في درجة الحموضة 7.5 إلى -Diketon. في معظم الحالات، يرافق الأكسدة تقسيم الرابطة الثلاثية بتشكيل الأحماض الكربوكسيلية:

إن إخراج التدمير التأكسدي من Alkinov صغير، وهذا رد الفعل لا يلعب دورا ملحوظا في التخليق العضوي. يتم استخدامه حصريا لإثبات هيكل حمض الأسيتيلين الطبيعي الوارد في أوراق النباتات الاستوائية في أمريكا الوسطى. مع تدمير التأكسد، تم عزل الأحماضين - لورينوفايا و Adipic. هذا يعني أن الحمض الأولي هو حمض 6 أوتاديزيك مع هيكل عظمي من الكربون العادي من ذرات الكربون السبعة عشر:
مزيج الأكسدة من Alkinov-1، تحفزه الأملاح النحاسية (رد فعل Goser-Eglinton) هو أكثر أهمية بكثير. في عام 1870، وجد جلامينر أن تعليق الأسيتيلين النحاسي (I)، في الكحول أكسدة الأكسجين الهواء مع تشكيل 1،3-DiOS:

بالنسبة إلى أكسدة الأسيتيليدات النحاسية (I)، فإن HexaciaranRate (III) من البوتاسيوم K 3 في DME أو DMF أكثر فعالية كعامل مؤكسد. في عام 1959، اقترح Eglinton تعديل أكثر ملاءمة بشكل كبير من التكثيف التأكسدي من Alkins. يتأكسد ألين من قبل النحاس (2) خلات في محلول بيريدين عند 60-70 درجة مئوية. تحول تعديل Eglinton إلى أن يكون مفيدا للغاية لتوليف polyls macrocycychychi من ، -DiOS. كما رسم توضيحي، نقدم تخليق اثنين من السيئين خلال التكثيف الأكسجين من HEXADIINE-1،5 (F. Zondheimer، 1960):

أحد polylys هو منتج سيكلوتريماريوني، والآخر - سيكلوت إلكترونية من Hesadine-1.5 الأصلي. يعمل Trigher ككواشف أولية لتوليف من -annule العطرية (للحصول على تفاصيل عن البلاص، انظر في الفصل 12). وبالمثل، في نفس الشروط من نونتادينا - 1.8، يتم الحصول على ديمر - 1،3،10،12-Cyclooktadekatetran، إلى جانب تقليل، رباعي العرب وبنتامتر:

للحصول على نظام غذائي غير متماثل، يتم استخدام تكثيف HalogenCetylene مع Alkine-1 (Terminal Alkine) في وجود أملاح النحاس (I) والأمانة الأولية (مزيج من Cadio-Khodkevich، 1957):

يتم الحصول على Bromoalkines الأولي بموجب العمل على Hyperobromit Alkina-1 الصوديوم أو من الليثيوم والبروم الأسيتيدرات:
يتم إنشاء مشتقات العسل في Alkina المعجمية مباشرة في خليط التفاعل من CU 2 CL 2 و Alkina-1.
6.3.4. ردود فعل اتصال الكهربائي على الثلاثي
تفاعلات الاتصال الكهربائي بالسند الثلاثي هي من بين ردود الفعل الأليفة الأكثر نموذجية وغير مهمة. على عكس إضافة كهربي للأكمين، كانت الاستخدام الاصطناعي لهذه المجموعة الكبيرة من ردود الفعل قدما قبل تطوير الأفكار النظرية حول آليتها. ومع ذلك، على مدى السنوات العشرين الماضية، تغير الوضع بشكل كبير وهو حاليا أحد المجالات السريعة النامية من الكيمياء العضوية الجسدية. يقع Alkina Wavelivend أدناه، Cesh Alken (الفصل 2)، وهذه الظروف محددة سلفا في الغالبية الساحقة من الحالات، السرعة السفلية لإضافة وكيل العامل الكهربائي إلى الكين مقارنة بالألكين. عامل آخر يحدد الفرق في تفاعل ألكينز والألكيرات في ردود أفعال الإضافة الكهرومائية هو الاستقرار النسبي للوسيطات الناشئة عند توصيل الجسيمات الكهربية بالسندات الثلاثية والمزدوجة. عندما يتم توصيل الجسيمات الكهربائية، يتم تشكيل كاربوكات دوري أو المفتوح (الفصل 5) إلى الرابطة المزدوجة. يؤدي مرفق H + أو E + إلى السندات الثلاثية إلى تكوين كاتيون فينيل مفتوح أو دوري. في الجيش الفينيل المفتوح الخطي، ذرة الكربون المركزي في sP.- حالة البريد، في حين شاغر رديئة-Ortogonal التواصل. بقية as. sP.- ذرة كبريد من الكربون الكربون كاتيل لديها إلكترونيات أعلى مقارنة ب sP. Atom Atom من ألكيل 2-Hybrid، يجب أن تكون كيشن الفينيل أقل استقرارا مقارنة ب Cations Alkyl:

هذه الحسابات الميكانيكية الكمومية، وكذلك البيانات الديناميكية الحرارية لمرحلة الغاز التي تم الحصول عليها باستخدام مطياف الكتلة ذات الضغط العالي وتكرير الرنين السيكلوترون، في الامتثال الكامل لهذه الحجج. في علامة التبويب. 6.3 البيانات الديناميكية الحرارية تعطى لتشكيل سلسلة من الكربونات الكربونية والهيدروكربونات التي تنتمي إلى مرحلة الغاز عند 25 درجة مئوية.
|
carboyation. |
Δ ن. f ˚ kcal / الخلد |
|
| |
|
| |
|
|
من البيانات المقدمة في تل. 6.3، يتبع أن كوزي الفينيل 47 KCAL / MOL أقل استقرارا مما كان عليه نفس عدد ذرات الكملية الإيثيل. يمكن القيام بنفس الاستنتاج من Enthalpy من التأين في مرحلة الغاز CH 3 CH 2 CL و CH 2 \u003d ChCL:
من السهل أن نرى أن مزيج من العوامل - كوزن الفينيل العالي والكينا المنخفضة وضعت - يمثل التفاعل السفلي من الكيرات المقارنة بالأكمان في ردود أفعال المرفق الكهربائي. في علامة التبويب. 6.4 بيانات مقارنة عن إضافة الهالوجين، سلفينو وكلوريد سيلينيل، حمض Trifluoroocetic والماء إلى مختلف الألكانات والألكينز، والتي لا تحتوي على أي مجموعة وظيفية تنشيط أو إلغاء تنفذة.
الجدول 6.4.
الخصائص النسبية للألكينز والألكين
في ردود أفعال المرفق الكهربائي
|
ركائز |
إلى Alkene / Alkin |
|
|
حمض الخليك برومومين |
الفصل 2 ch 2 / NSSN C 4 H 9 CH \u003d CH 2 / C 4N 9 SSN C 6 H 5 Ch \u003d CH 2 / C 6N 5 SSN | |
|
الكلورة |
C 6 H 5 Ch \u003d CH 2 / C 6N 5 SSN C 4 H 9 Ch \u003d CH 2 / C 6N 5 SSN C 2 H 5 C \u003d SNS 2N 5 / C 2N 5 SSS 2N 5 | |
|
مرفق 4-Chlorophenylsulfenchloride p-CLS 6 H 4 SECL |
الفصل 2 \u003d الفصل 2 / NSSN C 4 H 9 CH \u003d CH 2 / C 4N 9 SSN C 6 H 5 Ch \u003d CH 2 / C 6N 5 SSN | |
|
الملحق phenylselenchloride مع 6 h 5 secl |
الفصل 2 \u003d الفصل 2 / NSSN C 4 H 9 CH \u003d CH 2 / C 4N 9 SSN C 6 H 5 Ch \u003d CH 2 / C 6N 5 SSN | |
|
إرفاق حمض Trifluoroacetic. |
C 4 H 9 CH \u003d CH 2 / C 4N 9 SSN C 6 H 5 Ch \u003d CH 2 / C 6N 5 SSN C 2 H 5 CH \u003d CH 2 / C 2N 5 SSN | |
|
الترطيب الحمضي الحمضي |
C 4 H 9 CH \u003d CH 2 / C 4N 9 SSN C 2 H 5 Ch \u003d SNS 2N 5 / C 2N 5 SSS 2N 5 C 6 H 5 Ch \u003d CH 2 / C 6N 5 SSN |
من هذه البيانات، يتبع أن مجرد إضافة عوامل الحمضية والماء فقط إلى العلاقات الثلاثية والمزوجة تحدث بسرعات وثيقة. إضافة halogens، sulfhenchlorides وعدد من الكواشف الأخرى إلى ألكينز يتدفق في 10 2 10 مرات أسرع من ألكينز. هذا يعني أن الهيدروكربونات التي تحتوي على روابط ثلاثية ومزدوجة غير مصحوبة بشكل انتقائي إرفاق كواشف السندات المزدوجة بشكل انتقائي، على سبيل المثال:

يجب أن تعامل البيانات المتعلقة بالترطيب المقارن للألكينز والكماليات بحذر، لأن ترطيب ألكينز يتطلب الحفز من قبل أيونات الزئبق (II)، وهو غير فعال لإرفاق المياه على السندات المزدوجة. لذلك، فإن البيانات الموجودة على ترطيب الرابطة الثلاثية والمزدوجة، والتحدث بدقة، ليست قابلة للمقارنة.
يمكن تنفيذ إضافة الهالوجين، تربية الهالوجين، Sulfhenchlorides وغيرها من العوامل الكهربائية الأخرى، والتي يتم توضيحها بسهولة باستخدام الأمثلة التالية:



4.5. أكسدة الكنز
ينصح ردود أفعال الأكسدة الكينية بالقسمة إلى مجموعتين كبيرتين: ردود الفعل التي يتم فيها الحفاظ على الهيكل العظمي الكربوني ورد فعل التدمير المؤكسد للهيكل العظمي الكربوني من جزيء السندات المزدوجة. تشمل المجموعة الأولى من ردود الفعل الإحصاء، وكذلك هيدروكسيلات، مما أدى إلى تكوين Diols Vicinal (Glycols). في حالة الكنات الدورية أثناء هيدروكسيلات، يتم تشكيل Vicinal نشوة- أو رابطة الدول المستقلة-Dioles. تتضمن مجموعة أخرى تحلل الأوزون ورد فعل من الأكسدة الشاملة للأكمين، مما يؤدي إلى تكوين أنواع مختلفة من مركبات الكربونيل وأحماض الكربوكسيلية.
4.5.a. ردود الفعل الأكسدة للأكمين مع الحفاظ على هيكل عظمي من الكربون
1. الاغتياج (رد الفعل N.A. Prilezhev، 1909 جم)
aciclic alkens الدوري عند التفاعل مع peracid (suprachlotes) rcooh في شكل إبوكسيدات متوسطة غير مقطوعة غير مبالية (أوكسيران)، لذلك فإن رد الفعل نفسه يسمى رد فعل الاغتيال.
وفقا للتسمية الحديثة جوباك - دورة ثلاث أعضاء مع ذروت الأكسجين يسمى أوكسيرا.
يجب اعتبار إغواء ألكينس عملية متزامنة ومنسقة فيها لا تتورط الوسيط الأيوني لنوع هيدروكسيل. وبعبارة أخرى، فإن إغواء ألكينز هو عملية اصطناعي- تم استفارة ذرة الأكسجين واحد للتواصل المزدوج مع الحفاظ الكامل على التكوين البدئي عند الروابط المزدوجة.
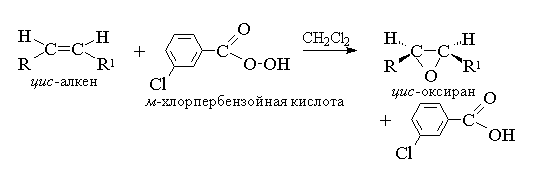

بالنسبة للإصبع، تم اقتراح آلية للعمليات المتفق عليها.

T. K. هجوم مزدوج السندات الذرة من الأكسجين الأكسجين يساوي بنفس القدر من جانبي طائرة السندات المزدوجة، أو أوامران تشكيلها إما ميسو- أشكال، أو مخاليط من enantiomers. يتم استخدام الخصوصية التالية كوكلاء Epoxidating: Pebenzoic، م.-Horperbenzoic، monoperfthal، الحار، trifluorceruce و permaneury. يتم استخدام Perkislotes من السلسلة العطرية في شكل الكواشف الفردية، في حين أن Perkislotes من الصفوف الأليفاتية - CH 3 CO 3 H، CF 3 CO 3 H و NSO 3 N غير معزولة بشكل فردي، ولكن يتم استخدامها بعد تكوينها أثناء التفاعل من 30٪ أو 90٪ بيروكسيد الهيدروجين وحمض الكربوكسيل المناسب. perbenzoic I. م.يتم الحصول على حامض كلوربربينزويك بسبب الأكسدة، على التوالي، البنزو م.أحماض كلورنزنزويك مع 70٪ بيروكسيد الهيدروجين في محلول حمض الميثانيسلفونيك أو من هيدريديدات الكلوريد لهذه الأحماض بيروكسيد الهيدروجين.


يتم الحصول على حامض Monoperfthalic بطريقة مماثلة من Anhydride الفثالي و 30٪ بيروكسيد الهيدروجين.

في البداية، تم استخدام أحماض Pebenzoic أو Monoperftic للحصول على أوكسيرانز (Epoxides):

حاليا، بالنسبة للإصبع، غالبا ما تستخدم م.حامض كلوربرسبنزويك. على عكس Perkslot الآخر، فإنه مستقر عند تخزينه لفترة طويلة (حتى سنة واحدة) وهو آمن تماما عند الاتصال به. المكوكات التي تم الحصول عليها خلال أكسدة الألكين الدردشة والكليك م.-Herperbenzoic حمض في محلول ميثيلين كلوريد، الكلوروفورم أو dioxane، وعادة ما تكون عالية جدا.



غالبا ما يتم إنشاء Perkislotes مباشرة في خليط التفاعل من 90٪ من بيروكسيد الهيدروجين وحمض الكربوكسيلية في كلوريد الميثيلين.


ألكنز مزدوجة السندات المرتبطة بمجموعة كربونيل أو استبدال مقبول آخر، منخفضة نشطة وأكسدة لها من الأفضل استخدام الأكسدة القوية، مثل حمض Trifluoroprocus الذي تم الحصول عليه من ANHYDRIDE الأحماض Trifluoroacetic و 90٪ بيروكسيد الهيدروجين في كلوريد الميثيلين. يتم الحصول على أبسط أوكسان - أكسيد الإيثيلين في الصناعة من خلال أكسدة الإيثيلين من الأكسجين في وجود الفضة، كحافز.

2. مضاد-hydroxylation.
يتم الكشف عن حلقة الأوكسيرانات الثلاثة الأعضاء بسهولة بموجب عمل مجموعة واسعة من الكواشف النيوكلوفيلية. سيتم مناقشة ردود الفعل هذه بالتفصيل في القسم المخصص للأثير البسيط من الدراجات والسيكل. سيتم النظر في التحليل الهيدروليكي فقط. تحفيز التحلل المائي للأوكسيرانات من قبل كل من الأحماض والقواعد. في كلتا الحالتين، يتم تشكيل Diols Vicinal، I.E. Glycols. في الحفز الحمض في المرحلة الأولى، يتم تدوير ذرة الأكسجين الأكسجين لتشكيل كوتينيوم دوري أوكسونيوم، والذي يتم الكشف عنه نتيجة لهجوم نويفي من جزيء المياه:

المرحلة الرئيسية في الكشف عن الحلبة، والتي تحدد سرعة العملية بأكملها هي الهجوم النيوكليوي بالماء على شكل البروتونات من أوكسيران. من وجهة نظر الآلية، تشبه هذه العملية الكشف عن أيون برومونيوم مع هجوم نوي الروفي لأيون بروميد أو وكيل نواة آخر. من هذه المواقف، يجب أن تكون النتائج المجسمة التعليمية نشوة- Glycols عند تقسيم الايبوكسيدات دورية. في الواقع، يتم تشكيل التحلل المائي المحفوظ للحمض من Cyclohexenoxide أو cyclopenthenoxide حصريا نشوة-1،2-ديول.

وبالتالي، فإن العملية من خطوتين من إحصاءات Alkene تليها تحلل الحمض في إجمالي الإيبوكسيد يتوافق مع رد الفعل مضاد- هيدروكسورات ألكنز.
كلا المرحلتين مضاد- يمكن دمج هيدروكسيلينغ من ألكينس إذا تم علاج ألكين ببروكسيد الهيدروجين المائي 30-70٪ في حمض النمل أو trifluoroacetic. كل من هذه الأحماض قوية بما يكفي للتسبب في الكشف عن دورة أوكسيرين.

يؤدي الكشف عن حلقة Oxyrane التي يحفزها القاعدة أيضا إلى تكوين دوري نشوة-لكليكولي.

وبالتالي، فإن العملية ذات المرحلة من مرحلتين من إحصاءات ألكنز مع التحلل القلوي اللاحق للإبوكسيدات هو أيضا رد فعل مضاد- هيدروكسورات ألكنز.
3. اصطناعي-hydroxylation.
بعض الأملاح والأكاسيد المعدنية الانتقالية في أعلى درجات الأكسدة هي الكواشف الفعالة. اصطناعي- هيدرولوجيا السندات المزدوجة من Alkenet عندما ينضم كل من مجموعات الهيدروكسيل من نفس الجانب من الاتصال المزدوج. أكسدة ألكينز Permanganate البوتاسيوم - واحدة من أقدم الطرق اصطناعي- هيدروكسورات التواصل المزدوج - لا يزال يستخدم على نطاق واسع، على الرغم من القيود المفروضة عليه. رابطة الدول المستقلة-1.2-Cyclohexanediol تم تلقيها لأول مرة بواسطة V.V. Markovnikov في عام 1878 من خلال هيدروكسيلات سيكلوهيكسدد مع محلول مائي من برمنجنات البوتاسيوم في 0 0 C.

تم تطوير هذه الطريقة في المستقبل في أعمال العالمة الروسية E.E. فاغنر، وبالتالي اصطناعي- يسمى هيدروكسورات ألكينز بموجب عمل محلول مائي من البوتاسيوم البرمجانات رد فعل فاغنر. Prommanganate البوتاسيوم هو عامل مؤكسد قوي لا يمكن أن يكون فقط هيدروكسي الرابطة المزدوجة، ولكن أيضا تقسيم تشكيل ديول النسائي. من أجل تجنب المزيد من الانقسام من Glycols، من الضروري مراقبة شروط التفاعل بعناية بعناية. عادة ما تكون مخارج Glycols في نفس الوقت صغيرا (30-60٪). يتم تحقيق أفضل النتائج في هيدروكسيلات ألكنز في وسط قلوي ضعيف (درجة الحموضة ~ 8 9) في 0-5 0 مع مخففة مع حل مائي بنسبة 1٪ من KMNO 4.


في البداية، خلال أكسدة البوتاسيوم البوتونجانات، يتم تشكيل الأثير الدوري من حمض المنغنيز، والذي يتم حدوثه على الفور إلى Diola Vicinal.

لم يكن إستر دوري من حمض المنغنيز كوسيط كوسيط، لكن تكوينه يتبع من تجارب مع المسمى 18 على Promganganate البوتاسيوم: يتم تصنيف ذرات الأكسجين في جليكول عندما تكون الكينا الأكسدة KMN 18 O 4. هذا يعني أن كلا ذرات الأكسجين تتحرك من المؤكسد، وليس من ماء المذيبات، وهو أمر جيد وفقا للآلية المقترحة.
طريقة اخرى اصطناعي- تم اقتراح هيدروكليز على ألكينز بموجب عمل أكسيد أسماوي (VIII) OSO 4 بواسطة R. Kryga في عام 1936. Osmia Tetraoxide هو عديم اللون، الطيران، بلوري، قابل للذوبان جيد على الهواء، ديوكسين، البيريدين، وغيرها من المذيبات العضوية. عندما يتفاعل Tetraoxide Osmium مع Alkanes في الهواء أو Dioxane، يتم تشكيل نسمة سوداء من Asmumic Familic Cyclic Est - Osmat، والتي يمكن عزلها بسهولة بشكل فردي. يتم تسريع إضافة OSO 4 إلى السندات المزدوجة بشكل ملحوظ في الحل في بيريدين. يتحلل تحلل الأوسماست إلى جليكولس النسائية من خلال عمل مائي هيدروسلفيت الصوديوم أو كبريتيد الهيدروجين.

مخارج المنتج اصطناعي-Hyndroxylation of Alkenes في هذه الطريقة أعلى بكثير من عند استخدام Prommanganate كعامل مؤكسد. إن ميزة مهمة لطريقة Krig هي عدم وجود منتجات تقسيم الأكسدة من ألكينس سمة من الأكسدة البرمجي.


Osmia Tetraoxide عبارة عن كاشف باهظ الثمن وملعب للغاية، وهو سام. لذلك، يتم استخدام أكسيد OSMIA (VIII) في توليفة كميات صغيرة من المواد الصعبة من أجل الحصول على أعلى إخراج ديول. من أجل تبسيط اصطناعيلقد تم تطوير تقنية -Hyndroxylation of Alkenes بموجب عمل OSO 4 بواسطة تقنية تسمح لنا باستخدام المبالغ الحفزية فقط من هذا الكاشف. يتم تنفيذ هيدروكسيلات Alkene باستخدام بيروكسيد الهيدروجين بحضور OSO 4، على سبيل المثال:

في ختام هذا القسم، نعطي علاقات نمطية كيميائية بين كلين رابطة الدول المستقلة- أو نشوة- تكوين وتكوين ديول النسخ المتشوئي، والتي يمكن أن تكون رابطة الدول المستقلة- أو نشوةزر، erytro.- أو تريو-غذاء ميسو- أو د، L.- المعلومات اعتمادا على النواب في كلين:

ورغفت العلاقات المجسمة الكيميائية المماثلة في ردود الفعل الأخرى اصطناعي- أو مضاد- خلال مضاعفة إمدادات الهيدروجين، الهيكليون، الماء، الهالوجين، هيدريدات البورون، وغيرها من الكواشف.
ردود الفعل الأكسدة التي تنطوي على المواد العضوية
يرتبط ميل المركبات العضوية للأكسدة بالحضور سندات متعددة، مجموعات وظيفية، ذرات الهيدروجين مع ذرة الكربون تحتوي على مجموعة وظيفية.
يمكن تمثيل الأكسدة المتسلسلة للمواد العضوية باعتبارها سلسلة التحويلات التالية:
Hydrocarbon المشبعة → الهيدروكربونات غير المشبعة → الكحول → الدهيد (كيتون) → حمض الكربوكسيل → CO 2 + H 2 O
يبدو أن العلاقة الوراثية بين فصول المركبات العضوية هي هنا كسلسلة من ردود الفعل الأكسدة التي توفر الانتقال من فئة واحدة من المركبات العضوية إلى أخرى. أكمل منتجاتها من الأكسدة الكاملة (الاحتراق) لأي من ممثلي فئات المركبات العضوية.
اعتماد الأكسدة والقدرة المعنية على المادة العضوية من هيكلها:
يرجع الاتجاه المتزايد للمركبات العضوية إلى الأكسدة في جزيء المواد:
- اتصالات متعددة (وهذا هو السبب في أن ألكنز، ألكينز، القلكادين تتأكسد بسهولة.
- مجموعات وظيفية محددةقادرة على السهل الأكسدة (- ش، أوه (الفينول والكحول)، - NH 2؛
- مجموعات الألكيل المنشطتقع مجاورة لاتصالات متعددة. على سبيل المثال، يمكن أن تتأكسد البروبان إلى الأكسجين غير محدد ألديهيد أوجيرين في وجود بخار الماء على محفزات البزموت الموليبدينوم.
H 2 C-CH-CH 3 → H 2 C --CH-COH
بالإضافة إلى أكسدة التولوين إلى حمض البنزويك برمناتجانات البوتاسيوم في بيئة حمضية.
5C 6 H 5 CH 3 + 6KMNO 4 + 9H 2 SO 4 → 5C 6 H 5 Cooh + 3K 2 SO 4 + 6MNSO 4 + 14H 2 O
- وجود ذرات الهيدروجين تحت الذرة الكربونية تحتوي على مجموعة وظيفية.
مثال على ذلك هو التفاعل في ردود أفعال أكسدة الكحوليات الأولية والثانوية والثالثية لتحقيق تفاعلية الأكسدة.
على الرغم من حقيقة أنه خلال أي ردود فعل رد فعل تأكسد يحدث الأكسدة والاسترداد، فإن التفاعل مصنف حسب ما يحدث مباشرة مع المركب العضوي (إذا كان يتأكسد، يقولون عن عملية الأكسدة، إذا تم استعادتها - حول عملية الاسترداد) وبعد
لذلك، عند رد فعل الإيثيلين مع إيثيلين Permanganate البوتاسيوم ستكون مؤكسدة، يتم استعادة Promganganate البوتاسيوم. يسمى التفاعل أكسدة الإيثيلين.
تطبيق مفهوم "درجة الأكسدة" (CO) في الكيمياء العضوية محدودا للغاية ويتم تنفيذه في المقام الأول في إعداد معادلات تفاعلات الأكسدة. ومع ذلك، بالنظر إلى أن تكوين أكثر أو أقل ثابتة لمنتجات التفاعل ممكنة فقط مع الأكسدة الكاملة (الاحتراق) من المواد العضوية، فإن نفعي وضع المعاملات في ردود أفعال الأكسدة غير المكتملة يختفي. لهذا السبب، وعادة ما يقتصر على إعداد دائرة تحويل المركبات العضوية.
عند دراسة الخصائص النسبية للمركبات غير العضوية والعضوية، أبلغنا باستخدام درجة الأكسدة (C.O.) (في الكيمياء العضوية، وخاصة الكربون) والأساليب الخاصة بتصميمها:
1) حساب متوسط \u200b\u200bS.O. الكربون في جزيء المادة العضوية:
-8/3 +1
يتم تبرير هذا النهج إذا تم تدمير جميع السندات الكيميائية (الاحتراق، التحلل الكامل) أثناء التفاعل في المادة العضوية.
2) تعريف S.O. كل ذرة الكربون:
في هذه الحالة، فإن درجة الأكسدة لأي ذرة الكربون في المركب العضوي تساوي المبلغ الجبري لأعداد جميع الروابط مع ذرات المزيد من العناصر الكهربية، مراعاة في الاعتبار مع علامة "+" على ذرة الكربون، و أخذ عدد السندات مع ذرات الهيدروجين (أو غيرها من العناصر الكهربائية الأخرى) في الاعتبار مع علامة "-" في ذرة الكربون. في هذه الحالة، لا تؤخذ الاتصالات مع ذرات الكربون المجاورة في الاعتبار.
كأبسط مثال، نحدد درجة أكسدة الكربون في جزيء الميثانول.
![]()
يرتبط ذرة الكربون بثلاثة ذرات الهيدروجين (هذه العلاقات مأخوذة في الاعتبار مع علامة "-")، رابطة واحدة مع ذرة الأكسجين (تؤخذ في الاعتبار مع علامة "+"). نحصل على: -3 + 1 \u003d -2. بالترتيب، تكون درجة أكسدة الكربون في الميثانول -2.
درجة المحاسبة من أكسدة الكربون هي، على الرغم من أن القيمة المشروطة، ولكنها تشير إلى طبيعة إزاحة كثافة الإلكترون في الجزيء، وتشير تغييرها نتيجة لرد الفعل إلى مكان لعملية تقليل الأكسدة.
نحدد في الحالات التي من الأفضل استخدامها واحدا أو طريقة أخرى.
عمليات الأكسدة، الاحتراق، الهالوجين، لطيفة، إزالة التجذيف، تتصل التحلل بعمليات الأكسدة.
عند الانتقال من فئة واحدة من المركبات العضوية إلى أخرى وزيادة درجة المتفرعة من هيكل عظمي الكربون جزيئات الاتصال داخل فئة منفصلة يتم تغيير درجة أكسدة ذرة الكربون المسؤولة عن إعادة القدرة على المركب.
المواد العضوية في جزيئاتها تحتوي على ذرات الكربون أقصى (- و +) قيم S. (-4، -3، +2، +3)، رد فعل حرق الأكسدة كاملة، ولكن مقاومة لآثار العوامل المؤكسدة الناعمة والعوامل المؤكسدة.
المواد الموجودة في جزيئاتها تحتوي على ذرات الكربون في شركة CO -1؛ 0؛ +1، تتأكسد بسهولة، قدرات استعادةها قريبة، يمكن تحقيق شاعر الأكسدة غير المكتملة على حساب واحد من المعروف مؤكسد صغير ومتوسطوبعد هذه المواد قد تمارس الطبيعة المزدوجة، والتحدث وكعامل مؤكسدتماما مثل هذه المواد غير العضوية المتأصلة.
عند كتابة معادلات ردود الفعل الاحتراق وتحلل المواد العضوية، من الأفضل استخدام متوسط \u200b\u200bقيمة C.O. كربون.
علي سبيل المثال:
![]()
دعونا نجعل معادلة التفاعل الكيميائي الكامل حسب الميزانية العمومية.
متوسط \u200b\u200bقيمة درجة أكسدة الكربون في H-Bhutan:
درجة الأكسدة الكربون في أكسيد الكربون (الرابع) هي +4.
سنصدر مخطط العمومية الإلكترونية

انتبه إلى النصف الأول من الرصيد الإلكتروني: عند ذرة الكربون في القيمة الكسرية ل C.O. القاسم هو 4، وبالتالي يتم إجراء حساب نقل الإلكترون وفقا لهذا المعامل.
أولئك. المرحلة الانتقالية من -2.5 إلى +4 يتوافق مع الانتقال 2.5 + 4 \u003d 6.5 وحدة. لأن 4 ذرات الكربون تشارك، 6.5 · 4 \u003d 26، وسيتم إعطاء الإلكترونات إلى ذررات الكربون الكلي من بوتان.
في ضوء المعاملات الموجودة، ستبدو معادلة الاحتراق الكيميائي من حرق N-Butane مثل هذا:
يمكنك استخدام طريقة تحديد التهمة الكلية ذرات الكربون في الجزيء:
(4 جيم) -10 …… → (1 جيم) +4، بالنظر إلى أن عدد الذرات إلى علامة \u003d وبعد أنه يجب التعادل بنفس القدر (4جيم) -10 …… →[(1 جيم) +4] 4
وبالتالي، يرتبط الانتقال من -10 إلى +16 بفقدان 26 إلكترونات.
في حالات أخرى، نحن نحدد قيم C.O. كل ذرة الكربون في المجمع، لفت الانتباه إلى تسلسل استبدال ذرات الهيدروجين في ذرات الكربون الأولية الثانوية والثالثية:


في البداية، عملية الاستبدال في التعليم العالي، ثم في الثانوية، وأخيرا من كل شيء - في ذرات الكربون الأساسي.
alkenes.
تعتمد عمليات الأكسدة على هيكل Alkenet ووسط التفاعل.
1. في أكسدة ألكينيس مع حل مركزي من permanganate البوتاسيوم kmno 4 في بيئة حمضية (الأكسدة الصلبة) هناك تمزق في الروابط σ- و π لتشكيل الأحماض الكربوكسيلية والكيتونات وأكسيد الكربون (الرابع). يتم استخدام هذا التفاعل لتحديد موضع السندات المزدوجة.
أ) إذا كان السندات المزدوجة موجودة في نهاية الجزيء (على سبيل المثال، في Bouthen-1)، فإن أحد منتجات الأكسدة هو حمض فورميك، ثم يتأكسد بسهولة إلى ثاني أكسيد الكربون والمياه:

ب) إذا كان في جزيء Alkin، فإن ذرة الكربون ذات السندات المزدوجة تضم بدائل اثنين من الكربون (على سبيل المثال، في جزيء 2 ميثيل بوتين -2)، ثم عندما يكون الأكسدة، تشكيل كيتون، T. K. تحويل مثل هذا الذرة إلى ذرة مجموعة الكربوكسيل أمر مستحيل دون كسر الاتصالات C-C-C، مستقرة نسبيا في ظل هذه الشروط:

ج) إذا كانت جزيء Alkene متماثل وترد السندات المزدوجة في منتصف الجزيء، فسيتم تشكيل حمض واحد فقط أثناء الأكسدة:

ميزة أكسدة ألكين، حيث تضم ذرات الكربون في السندات المزدوجة اثنين من راديكاليين الكربون، وهي تشكيل اثنين من الكيتونات:


2. مع وسائل الإعلام القلوية المحايدة أو الضعيفة، يرافق الأكسدة تكوين Diols (كحوليات القناة الصناعية) ، حيث انضمت مجموعات هيدروكسيل إلى ذرات الكربون، حيث كان هناك سند مزدوج:

أثناء رد الفعل هذا، يتم تغيير لون اللون الأرجواني للحل المائي KMNO 4. لذلك يتم استخدامه رد فعل الجودة على ألكينس (رد فعل فاغنر).
3. أكسدة ألكينز في وجود أملاح بالاديوم (عملية شاذير) يؤدي إلى التعليم الألدهيد والكيتونات:
2ch 2 \u003d CH 2 + O 2 PDCL2 / H2O. → 2 CH 3 -CO-H
يتأكسج هومولوجيون إلى ذرة الكربون الأقل مهدرجة:
sh 3 -ch 2 -ch \u003d CH 2 + 1 / 2O 2 PDCL2 / H2O. → CH 3 - CH 2 -CO-CH 3
ألكينا
يتدفق أكسدة الأسيتيلين ومتمنيا له اعتمادا على عائدات العملية في أي بيئة.
لكن) في بيئة حمضية، ترافق عملية الأكسدة لتشكيل الأحماض الكربوكسيلية:

يتم استخدام التفاعل لتحديد هيكل Alkins على منتجات الأكسدة:

في وسائل الإعلام المحايدة والقليلة، يرافق أكسدة الأسيتيلين من تكوين الأكسالات المناسبة (أملاح حمض الأكساليك)، وأكسج هومولوجيز هو انهيار السندات الثلاثية وتشكيل أملاح حمض الكربوكسيلية:

بالنسبة للأسيتيلين:
1) في بيئة حمضية:
H-C≡C-H kmno. 4, حاء 2 وبالتالي. 4 → Hooc Cooh (حمض الساحف)
3CH≡CH + 8KMNO 4 حاء 2 في→ 3KOOC Cook. البوتاسيوم أكسفالات + 8MNO 2 ↓ + 2KOH + 2H 2 O
الساحة
(البنزين ومنتجاته)
في أكسدة الساحة في وسط حمضي، ينبغي توقع تكوين حمض، وفي القلوية - الأملاح.
يتأكسد غومزول هانولوجيات مع سلسلة جانبية واحدة (بغض النظر عن طولها) من قبل وكيل مؤكسد قوي حمض البنزويك من قبل ذرة الكربون α. تتأكسج Gomezol Homologs بواسطة برمنجنات البوتاسيوم في وسيلة محايدة لتشكيل أملاح البوتاسيوم من الأحماض العطرية.
5C 6 H 5 -CH 3 + 6KMNO 4 + 9H 2 SO 4 \u003d 5C 6 H 5 Cooh + 6MNSO 4 + 3K 2 SO 4 + 14H 2 O،
5C 6 H 5 -C 2 H 5 + 12KMNO 4 + 18H 2 حتى 4 \u003d 5C 6 H 5 Cooh + 5CO 2 + 12MNSO 4 + 6K 2 SO 4 + 28H 2 O،
C 6 H 5 -CH 3 + 2KMNO 4 \u003d C 6 H 5 كوك + 2MNO 2 + KOH + H 2 O.
نؤكد أنه إذا كان هناك عدة سلاسل جانبية في الجزيء، فإن كل واحد منهم يتأكسد كل واحد منهم وفقا للذرة الكربونية لمجموعة Carboxym، نتيجةها التي يتم تشكيل الأحماض العطرية الصليانية:

1) في بيئة حمضية:
ج 6 ساعة 5 -CH 2 -R kmno. 4, حاء 2 وبالتالي. 4 → C 6 H 5 -COOH حمض البنزويك+ co 2.
2) في بيئة محايدة أو قلوية:
ج 6 ساعة 5 -CH 2 -R KMNO4، H2O / (أوه)→ C 6 H 5 -Cook + CO 2
3) الأكسدة من محومات البنزين permanganate البوتاسيوم أو البوتاسيوم bichromate عند تسخينها:
ج 6 ساعة 5 -CH 2 -R kmno. 4, حاء 2 وبالتالي. 4, T. ˚ جيم→ C 6 H 5 -COOH حمض البنزويك+ r-cooh
4) أكسدة أكسجين cumene في وجود محفز (طريقة كومة لإنتاج الفينول):
C 6 H 5 CH (CH 3) 2 O2، H2SO4.→ C 6 H 5 -OH فينول + CH 3 -CO-CH 3 الأسيتون
5C 6 H 5 CH (CH 3) 2 + 18KMNO 4 + 27H 2 حتى 4 → 5c 6 ساعة 5 Cooh + 42h 2 O + 18MNSO 4 + 10CO 2 + K 2
C 6 H 5 CH (CH 3) 2 + 6H 2 O - 18C→ C 6 H 5 Cooh + 2CO 2 + 18H + | × 5.
MNO 4 - + 8H + + 5ē→ MN +2 + 4H 2 O | × 18.
يجب أن تدفع الاهتمام ذلك متى الأكسدة الناعمة من Styrene Permanganate Potassium KMNO 4 في متوسطة محايدة أو قليلة قليلاهناك فجوة π-Meansy، يتم تشكيل glycol (الكحول الصناعي). نتيجة لرد الفعل، يتم تفريغ الحل المرسول من برمنجنات البوتاسيوم بسرعة وترسب بني لأكسيد المنغنيز (الرابع).
أكسدة نفسه مؤكسد قوي - Preshanganate البوتاسيوم في وسط حمضي - يؤدي إلى استراحة كاملة من الرابطة المزدوجة وتشكيل ثاني أكسيد الكربون وحمض البنزويك، المحلول يبيض.
C 6 H 5 -CH Mon 2 + 2 KMNO 4 + 3 H 2 SO 4 → C 6 H 5 -COOH + CO 2 + K 2 SO 4 + 2 MNSO 4 +4 H 2 O
الكحول
يجب أن نتذكر ذلك:
1) يتأكسد الكحول الأساسي للألدهيدز:
3CH 3 -CH 2 OH + K 2 CR 2 O 7 + 4H 2 SO 4 \u003d 3Cho 3 -Cho + K 2 SO 4 + CR 2 (حتى 4) 3 + 7h 2 O؛
2) الكحول الثانوي تتأكسد إلى الكيتونات:

3) لكحوليات التعليم العالي، فإن رد فعل الأكسدة غير مميزة.
كحوليات التعليم العالي، في جزيئات أي ذرة هيدروجين مع ذرة الكربون تحتوي على مجموعة، لا يتأكسد في الظروف العادية. في ظروف قاسية (تحت عمل عوامل مؤكسدة قوية وفي درجات حرارة عالية)، يمكن أن تتأكسد إلى مزيج من الأحماض الكربوكسيلية ذات الوزن المنخفضة الجزيئية، أي يحدث تدمير هيكل عظمي الكربون.
عندما يتأكسد الميثانول من قبل الحل الحامض من برمنجنات البوتاسيوم أو dichromate البوتاسيوم، يتم تشكيل CO 2.
يمكن أن تشكل الكحول الأولي أثناء الأكسدة، اعتمادا على شروط التفاعل، ألدهيد فقط، ولكن أيضا الأحماض.
على سبيل المثال، أكسدة الإيثانول مع البوتاسيوم Dichromate على النهايات الباردة مع حزام حمض الخليك، وعند تسخينه - الأسيتالديهيد:
3CH 3 -CH 2 OH + 2K 2 CR 2 O 7 + 8H 2 حتى 4 \u003d 3CH 3 -COOH + 2K 2 إذن 4 + 2CR 2 (حتى 4) 3 + 11h 2 O،
إذا كانت ثلاث مجموعات أو أكثر ترتبط مع ذرات الكربون المجاورة، فمن خلال أكسدة حمض اليود، يتم تحويل الذرات المتوسطة أو المتوسطة إلى حمض الفوركي
يمتد أكسدة غليكولز برمناتجانات البوتاسيوم في وسط حمضي مماثل إلى الانقسام المؤكسد للأكمان ويؤدي أيضا إلى تكوين الأحماض أو الكيتون بناء على هيكل الجليكول الأصلي.
الألدهيد والكيتونيس
الألدهيديس أسهل من الكحوليات، مؤكسدة في أحماض الكربوكسيل المناسبة ليس فقط تحت عمل المؤكسين القويين (الأكسجين الجوي، الحلول الحمضية من KMNO 4 و K 2 CR 2 O 7)، ولكن أيضا بموجب عمل ضعيف (محلول الأمونيا من الفضة أكسيد أو هيدروكسيد النحاس (II)):
5CH 3 -Cho + 2kmno 4 + 3H 2 حتى 4 \u003d 5CH 3 -COOH + 2MNSO 4 + K 2 SO 4 + 3H 2 O،
3CH 3 -Cho + K 2 CR 2 O 7 + 4H 2 لذلك 4 \u003d 3CH 3 -COOH + CR 2 (هكذا 4) 3 + K 2 حتى 4 + 4h 2 O،
CH 3 -CHO + 2OH CH 3 -COONH 4 + 2AG + 3NH 3 + H 2 O
انتباه خاص!!! يؤدي أكسدة الميثانال إلى محلول الأمونيا من أكسيد الفضة إلى تشكيل كربونات الأمونيوم، وليس حمض الفورميك:
Hch.حول + 4OH \u003d (NH 4) 2 CO 3 + 4AG + 6NH 3 + 2H 2 O.
لتجميع معادلات ردود الفعل التي تقلل من الأكسدة، يتم استخدام كل من طريقة التوازن الإلكتروني وطريقة نصف تشكيل (طريقة الإلكترون أيون).
بالنسبة للكيمياء العضوية، فإن درجة أكسدة الذرة مهمة، وإزاحة كثافة الإلكترون، ونتيجة لذلك تظهر الرسوم الجزئية على الذرات، لا تتفق بأي حال من الأحوال مع قيم درجات الأكسدة.
تشمل العديد من الجامعات في تذاكر لامتحانات مدخل مهمة اختيار المعاملات في معادلات OPR بواسطة طريقة إلكترونية أيون (بنصف التكوين). إذا كان في المدرسة ودفع بعض الاهتمام على الأقل لهذه الطريقة، فما أساسا في أكسدة المواد غير العضوية.
دعونا نحاول تطبيق طريقة نصف التكوين لأكسدة البوتاسيوم برمجانات السكروز في بيئة حمضية.
ميزة هذه الطريقة هي أنه ليس هناك حاجة إلى تخمين وتسجيل منتجات التفاعل على الفور. يتم تحديدها بسهولة إلى حد ما أثناء المعادلة. يتجلى المؤكسد في المتوسطة الحمضية بالكامل خصائصها الأكسدة بالكامل، على سبيل المثال، يتحول Anion MNO - إلى MN 2+ كاتيون، تتأكسد المركبات العضوية التي تتأكسد بسهولة إلى CO 2.
نحن نكتب في الشكل الجزيئي لتحويل السكروز:
![]()
في الجزء الأيسر، هناك نقص في 13 ذرات الأكسجين للقضاء على هذا التناقض، أضف 13 جزيئات H 2 O.
يحتوي الجزء الأيسر الآن على 48 ذرات الهيدروجين، يتم إصدارها في شكل N + Cations:
الآن تساوي إجمالي الرسوم على اليمين واليسار:
مخطط SEMI- رد الفعل جاهز. عادة ما يسبب رسم نظام تكوين النصف الثاني صعوبات:
الجمع بين كلا الخطط:
![]()
مهمة للعمل المستقل:
إنهاء UHR وانتشر المعاملات من خلال طريقة الرصيد الإلكتروني أو بنصف التكوين:
CH 3 -CH \u003d Ch-CH 3 + KMNO 4 + H 2 حتى 4 →
CH 3 -CH \u003d Ch-CH 3 + KMNO 4 + H 2حول →
(CH 3) 2 C \u003d C-CH 3 + KMNO 4 + H 2 حتى 4 →
CH 3 -CH 2 -CH \u003d CH 2 + KMNO 4 + H 2 حتى 4 →
معH 3 -CH 2 -C≡-CH 3 + KMNO 4 + H 2 حتى 4 →
C 6 H 5 -CH 3 + KMNO 4 + H2O →
C 6 H 5 -C 2 H 5 + KMNO 4 + H 2 حتى 4 →
جيم 6 حاء 5 - ش. 3 + kmno. 4 + حاء 2 وبالتالي. 4 →
ملاحظاتي:
يجب إيلاء اهتمام خاص للطلاب لسلوك الأكسدة - permanganate البوتاسيوم kmno 4 في بيئات مختلفة. يرجع ذلك إلى حقيقة أن تفاعلات الأكسدة الموجودة في كيما ليست فقط في المهام C1 و C2. في مهام NW، تمثل سلسلة تحويل المواد العضوية، غالبا ما تكون معادلة أكسدة الحد. في المدرسة، غالبا ما يتم تسجيل المؤكسيد فوق السهم باسم [O]. إن شرط الوفاء بهذه المهام على الاستخدام هو التعيين الإلزامي لجميع المواد البداية ومنتجات العلاج مع ترتيب المعاملات اللازمة.